Diferencia entre el ácido carboxílico y el alcohol

Ácido carboxílico vs alcohol
Los ácidos carboxílicos y los alcoholes son moléculas orgánicas con grupos funcionales polares. Ambos tienen la capacidad de hacer enlaces de hidrógeno, que afectan sus propiedades físicas como puntos de ebullición.
Ácido carboxílico
Los ácidos carboxílicos son los compuestos orgánicos que tienen el grupo funcional -cooh. Este grupo se conoce como el grupo Carboxyl. El ácido carboxílico tiene una fórmula general de la siguiente manera.
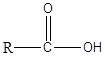
En el tipo más simple de ácido carboxílico, el grupo R es igual a H. Este ácido carboxílico se conoce como ácido fórmico. Además, el grupo R puede ser una cadena de carbono recta, cadena ramificada, grupo aromático, etc. El ácido acético, el ácido hexanoico y el ácido benzoico son algunos de los ejemplos de ácidos carboxílicos. En la nomenclatura de IUPAC, los ácidos carboxílicos se nombran dejando caer la final -mi del nombre del alcano correspondiente a la cadena más larga del ácido y agregando -ácido oic. Siempre, el carbono carboxyl se asigna el número 1. Los ácidos carboxílicos son moléculas polares. Debido al grupo -OH, pueden formar fuertes enlaces de hidrógeno entre sí y con agua. Como resultado, los ácidos carboxílicos tienen altos puntos de ebullición. Además, los ácidos carboxílicos con pesos moleculares más bajos se disuelven fácilmente en agua. Sin embargo, a medida que aumenta la longitud de la cadena de carbono, la solubilidad disminuye. Los ácidos carboxílicos tienen una acidez que va desde PKA 4-5. Como son ácidos, reaccionan fácilmente con NaOH y Nahco3 Soluciones para formar sales de sodio soluble. Los ácidos carboxílicos como el ácido acético son ácidos débiles, y existen en equilibrio con su base conjugada en medios acuosos. Sin embargo, si los ácidos carboxílicos tienen grupos que retiran electrones como CL, F, son ácidos que el ácido no sustituido.
Alcohol
La característica de la familia de alcohol es la presencia de un grupo funcional de un -OH (grupo hidroxilo). Normalmente, este grupo -Oh está unido a un SP3 carbono hibridizado. El miembro más simple de la familia es el alcohol metílico, que también se conoce como metanol. Los alcoholes se pueden clasificar en tres grupos como primario, secundario y terciario. Esta clasificación se basa en el grado de sustitución del carbono al que el grupo hidroxilo se adjunta directamente. Si el carbono solo tiene otro carbono unido, se dice que el carbono es un carbono primario y el alcohol es un alcohol primario. Si el carbono con el grupo hidroxilo está unido a otros dos carbonos, entonces ese es un alcohol secundario y así sucesivamente. Los alcoholes se nombran con un sufijo -olio Según la nomenclatura de IUPAC. Primero, se debe seleccionar la cadena de carbono continua más larga a la que se adjunta el grupo hidroxilo directamente. Entonces el nombre del alcano correspondiente se cambia dejando caer la final mi y agregando el sufijo olio.
Los alcoholes tienen un punto de ebullición más alto que los hidrocarburos o éteres correspondientes. La razón de esto es la presencia de interacción intermolecular entre las moléculas de alcohol a través de la unión de hidrógeno. Si el grupo R es pequeño, los alcoholes son miscibles con el agua, pero a medida que el grupo R se está haciendo más grande, tiende a ser hidrófobo. Los alcoholes son polares. Los enlaces C-O y O-H contribuyen a la polaridad de la molécula. La polarización del enlace O-H hace que el hidrógeno sea parcialmente positivo y explica la acidez de los alcoholes. Los alcoholes son ácidos débiles, y la acidez está cerca de la del agua. -Oh es un pobre grupo de abandono, porque oh- es una base fuerte.
| Cuál es la diferencia entre Ácido carboxílico y alcohol? • El grupo funcional de ácido carboxílico es -cooh, y en alcohol es -oh. • Cuando ambos grupos están en una molécula, se da prioridad al ácido carboxílico en la nomenclatura. • Los ácidos carboxílicos tienen una mayor acidez en comparación con los alcoholes correspondientes. • El grupo carboxílico y el grupo -OH ofrecen picos característicos en los espectros IR y RMN. |


