Diferencia entre chaperonas y chaperoninas
El diferencia clave Entre los acompañantes y las chaperoninas es que Los chaperonas realizan una amplia gama de funciones que incluyen plegamiento y degradación de la proteína, ayudando en el ensamblaje de proteínas, etc., Mientras que la función clave de las chaperoninas es ayudar en el plegado de moléculas de proteínas grandes.
Los chaperones moleculares o las chaperonas son moléculas de proteínas que ayudan en el proceso de plegamiento de proteínas en estructuras complejas. Por lo tanto, las chaperoninas son un tipo de chaperona, que incluye proteínas de choque térmico. De todos los tipos de chaperonas, las chaperoninas son las proteínas más ampliamente estudiadas debido al importante papel que desempeña durante el plegamiento de proteínas correcto. Por lo tanto, la acción de las chaperonas y las chaperoninas impide la agregación irreversible de proteínas y, por lo tanto, permite su funcionalidad. Las chaperonas y las chaperoninas difieren minuciosamente en función de la funcionalidad de las dos moléculas.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué son los chaperones?
3. ¿Qué son las chaperoninas?
4. Similitudes entre chaperonas y chaperoninas
5. Comparación lado a lado: chaperonas vs chaperoninas en forma tabular
6. Resumen
¿Qué son los chaperones??
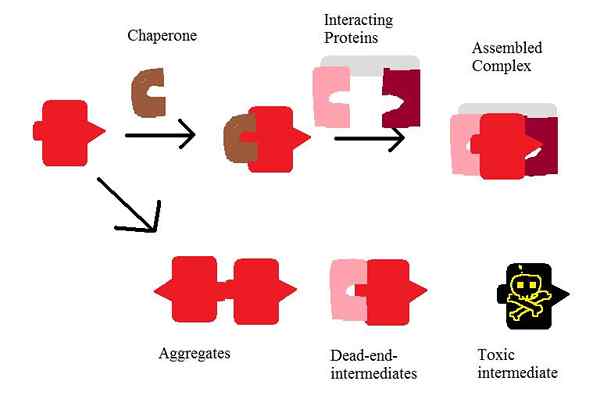
Las chaperonas son proteínas que ayudan en el ensamblaje de proteínas, el plegamiento de proteínas y en el proceso de degradación de las proteínas. Por lo tanto, hay muchas clases de chaperones moleculares. Los acompañantes que se unen a las superficies hidrofóbicas de las proteínas facilitan el plegamiento y evitan la agregación irreversible de proteínas. Además, los chaperones se pueden clasificar en diferentes clases en función del tamaño y el compartimento celular. Las chaperoninas son una de las clases más importantes de chaperones, que son las proteínas de choque térmico.

Figura 01: Acción de Chaperon
Además, las chaperonas son necesarias para el proceso de degradación de proteínas. Cuando las proteínas sufren un plegamiento indebido, las chaperonas están involucradas en el proceso de ubiquitinación que conduce a la destrucción de la proteína.
¿Qué son las chaperoninas??
La chaperonina es una clase de chaperonas que están específicamente involucradas en el plegado de proteínas grandes. Tienen una estructura específica. Las chaperoninas comprendían una estructura de dos anillos que puede ser homo - dimérica o hetero -dimérica. Estas dos estructuras de anillo forman dos cavidades centrales. Cada subunidad tiene un dominio que puede unirse a la superficie hidrófoba de la proteína. Una vez que se lleva a cabo la unión, las chaperoninas traen un cambio conformacional en la proteína. Esto permite el plegado correcto de la proteína.

Figura 02: Chaperonins
Hay dos categorías principales de chaperoninas, a saber, el Grupo I Chaperonins y el Grupo II Chaperonins. Las chaperoninas del Grupo I son procariotas y incluyen principalmente las proteínas de choque térmico bacteriano como HSP60 y Groel procariota. Las chaperoninas del Grupo II incluyen el Archean y las chaperoninas eucariotas. Algunas de las chaperoninas del Grupo II son polipéptidos y groes relacionados con el complejo T.
¿Cuáles son las similitudes entre chaperonas y chaperoninas??
- Las chaperonas y las chaperoninas son proteínas.
- Están involucrados principalmente en el plegado de proteínas.
- Ambos se unen a las regiones hidrofóbicas de la proteína.
- Se pueden sintetizar in vitro y se puede usar en una gran cantidad de investigaciones relacionadas con el plegado de proteínas mal.
¿Cuál es la diferencia entre chaperonas y chaperoninas??
Los chaperonas son proteínas que involucran en el plegamiento de proteínas, degradación y ensamblaje. Por lo tanto, hay varias subclases de chaperones basadas en el mecanismo de acción. Algunos involucran en el plegamiento de proteínas, mientras que otros involucran en la solubilización de proteínas agregadas. Por otro lado, las chaperoninas son un tipo de chaperonas, que implican específicamente en el plegado de proteínas grandes. Esta es la diferencia clave entre chaperons y chaperonins. Además, hay dos grupos de chaperoninas; Grupo I Chaperonins y Chaperonins del Grupo II.
La siguiente infografía presenta la diferencia entre chaperons y chaperoninas en forma tabular.
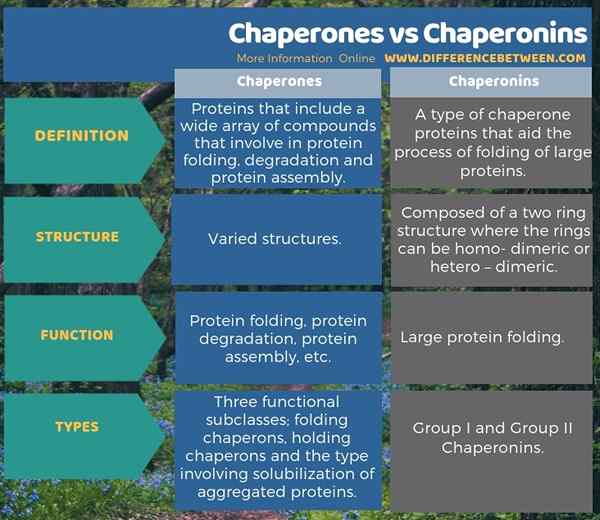
Resumen -Chaperones vs Chaperonins
Los chaperones son una clase amplia de biomoléculas, que son proteínas. Ayudan en el plegamiento de proteínas, degradación y ensamblaje de proteínas. Las chaperoninas son una clase de chaperonas que funcionan específicamente en el plegado de proteínas grandes. Por lo tanto, la diferencia clave entre los chaperons y las chaperoninas se basa en la función de las dos proteínas. También difieren en estructura. Los chaperonas varían en estructura, mientras que las chaperoninas tienen una estructura específica de dos anillados.
Referencia:
1.EslavoTinek, A M y L G Biesecker. "Despliegue el papel de las chaperonas y las chaperoninas en la enfermedad humana." Avances en pediatría., U.S. Biblioteca Nacional de Medicina, septiembre. 2001. Disponible aquí
Imagen de cortesía:
1."Proteínas de membrana en complejos" por Medievalpacman - trabajo propio, (CC BY -SA 3.0) a través de Commons Wikimedia
2."Groes-Groel Top" por ningún autor legible por máquina proporcionado. (Dominio público) a través de Commons Wikimedia


