Diferencia entre el equilibrio químico y el equilibrio dinámico
El diferencia clave entre el equilibrio químico y el equilibrio dinámico es que el El equilibrio químico describe el estado en el que las concentraciones de reactivos y productos no sufren ningún cambio, mientras que el equilibrio dinámico describe el estado en el que la relación de reactivos y productos no cambia, pero las sustancias se mueven entre los químicos a una velocidad igual.
Cuando uno o más reactivos se convierten en productos, pueden pasar por diferentes modificaciones y cambios de energía. Los enlaces químicos en los reactivos se están rompiendo, y se están formando nuevos enlaces para generar productos, que son totalmente diferentes de los reactivos. Nombre este tipo de modificación química como reacción química. La termodinámica es el estudio de transformaciones de energía que se refiere a lo energético y la posición del equilibrio en una reacción.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es el equilibrio químico?
3. ¿Qué es el equilibrio dinámico?
4. Comparación de lado a lado: equilibrio químico versus equilibrio dinámico en forma tabular
6. Resumen
¿Qué es el equilibrio químico??
El equilibrio químico es el estado en el que tanto los reactivos como los productos están presentes en concentraciones que no tienen más tendencia a cambiar con el tiempo. Algunas reacciones son reversibles, y algunas reacciones son irreversibles. En una reacción, los reactivos se están convirtiendo a productos. Y en algunas reacciones, los reactivos se generan nuevamente a partir de los productos. Por lo tanto, este tipo de reacción es reversible.
En reacciones irreversibles, una vez que los reactivos se convierten en productos, no se regeneran nuevamente de los productos. En una reacción reversible cuando los reactivos van a los productos, lo llamamos la reacción hacia adelante, y cuando los productos van a reactivos, es la reacción hacia atrás.

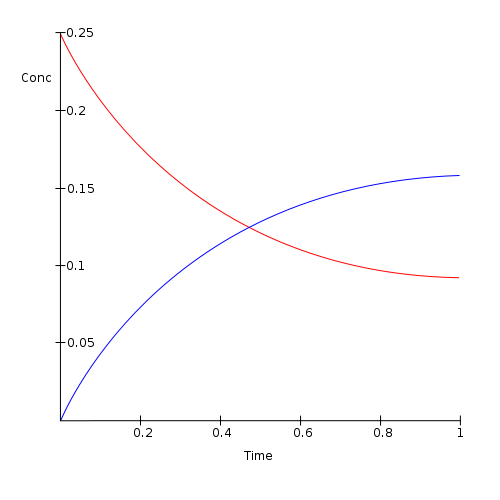
Figura 01: la cantidad de reactivos (en rojo) disminuye y la cantidad de productos (en azul) aumenta después del equilibrio químico
Naturaleza de la reacción
Cuando la velocidad de reacciones hacia adelante y hacia atrás es igual, entonces la reacción está en equilibrio. Por lo tanto, durante algún tiempo la cantidad de reactivos y productos no está cambiando. Las reacciones reversibles siempre tienden a llegar al equilibrio y mantienen ese equilibrio. Cuando el sistema está en equilibrio, la cantidad de productos y los reactivos no son necesariamente iguales. Puede haber una mayor cantidad de reactivos que los productos o viceversa. El único requisito en una ecuación de equilibrio es mantener una cantidad constante de ambos con el tiempo. Para una reacción en equilibrio, podemos definir una constante de equilibrio; donde es igual a la relación entre la concentración de productos y la concentración de reacciones.
K = [producto]norte/[Reactivo]metro
Dónde, N y M son los coeficientes estequiométricos del producto y el reactivo. Para una reacción de equilibrio, si la reacción directa es exotérmica, entonces la reacción hacia atrás es endotérmica y viceversa. Normalmente, todos los demás parámetros para reacciones hacia adelante y hacia atrás son opuestas entre sí como esta. Por lo tanto, si queremos facilitar cualquiera de las reacciones, simplemente tenemos que ajustar los parámetros para facilitar esa reacción.
¿Qué es el equilibrio dinámico??
El equilibrio dinámico también es un tipo de equilibrio donde las cantidades de productos y reactivos no cambian con el tiempo. Sin embargo, en el equilibrio dinámico, al decir que las cantidades no cambian no significa que la reacción se haya detenido. Más bien, la reacción avanza de una manera que mantiene las cantidades sin cambios (el cambio neto es cero).
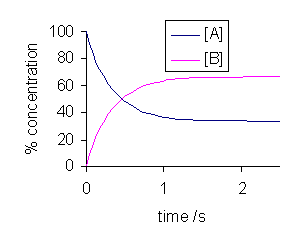
Figura 02: Cambio de reacciones hacia adelante y hacia atrás en un equilibrio dinámico
Simplemente la palabra "equilibrio dinámico" significa que la reacción es reversible y continua. Para que se realice un equilibrio dinámico, el sistema debe estar cerrado, de modo que ninguna energía o materia escape del sistema.
¿Cuál es la diferencia entre el equilibrio químico y el equilibrio dinámico??
El equilibrio dinámico es un tipo de equilibrio químico. La diferencia clave entre el equilibrio químico y el equilibrio dinámico es que el equilibrio químico describe el estado en el que las concentraciones de reactivos y productos no sufren ningún cambio, mientras que el equilibrio dinámico describe el estado en el que la relación de reactivos y productos no cambia, pero las sustancias se mueven entre los productos químicos a la misma velocidad.
Además, en un equilibrio dinámico, la reacción continúa, pero la cantidad de reactivos y productos permanece sin cambios porque las tasas de las reacciones hacia adelante y hacia atrás son las mismas. Puede haber algunos casos en el equilibrio químico donde las cantidades de productos y reactivos permanecen sin cambios porque la reacción se ha detenido. Entonces, esta también es una diferencia entre el equilibrio químico y el equilibrio dinámico.
Por debajo de la infografía sobre la diferencia entre el equilibrio químico y el equilibrio dinámico, proporciona más información sobre estas diferencias.

Resumen: equilibrio químico versus equilibrio dinámico
Un equilibrio es un estado de un sistema que no muestra un cambio neto. El equilibrio químico obtiene este estado cuando la reacción se detiene, mientras que el equilibrio dinámico obtiene este estado cuando las velocidades de reacción hacia adelante y hacia atrás son iguales. La diferencia clave entre el equilibrio químico y el equilibrio dinámico es que el equilibrio químico describe el estado en el que las concentraciones de reactivos y productos no experimentan ningún cambio, mientras que el equilibrio dinámico describe el estado en el que la relación de reactivos y productos no cambia, sino sustancias, sino sustancias moverse entre los productos químicos a la misma velocidad.
Referencia:
1. "Equilibrio químico: tipos, principios y leyes de equilibrio."Toppr bytes, toppr.com, 16 mar. 2018. Disponible aquí
"Equilibrio dinámico."Wikipedia, Fundación Wikimedia, 17 de diciembre. 2018. Disponible aquí
Imagen de cortesía:
1."ChemicalEquilibrium" de Fintelia - Trabajo propio, (CC BY -SA 3.0) a través de Commons Wikimedia
2."Equilibrio dinámico" de PeterGans en English Wikipedia - Trabajo propio (dominio público) a través de Commons Wikimedia


