Diferencia entre clorito y cloruro
El Diferencia clave entre clorito y cloruro es que el ion clorito es un agente fuertemente oxidante, mientras que el cloruro no es un agente oxidante.
El clorito y el cloruro son aniones derivados de átomos de cloro. Estos aniones pueden aumentar sus estados de oxidación durante una reacción química, pero solo el ion de clorito puede reducir su estado de oxidación además, mientras que el ion cloruro no puede. Por lo tanto, el clorito es un agente oxidante, pero el ion cloruro no es.
CONTENIDO
1. Descripción general y diferencia de claves
2. Que es el clorito
3. Que es el cloruro
4. Comparación de lado a lado: clorito vs cloruro en forma tabular
5. Resumen
Que es el clorito?
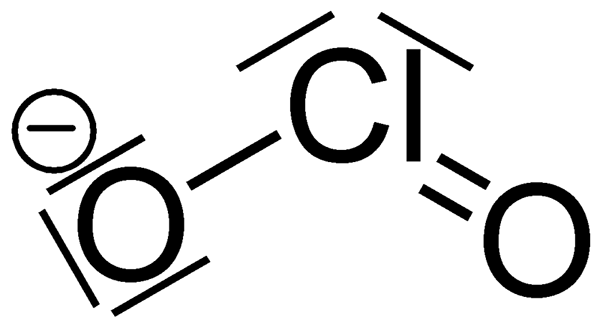
El clorito es un anión que tiene la fórmula química clo2-. La masa molar de este anión es 67.45 g/mol. También se conoce como anión de dióxido de cloro, y es un ejemplo de halite. Los compuestos de clorito son compuestos químicos que contienen este anión; El cloro está en el estado de oxidación de +3. Los cloritos son las sales de ácido clorous.
Al considerar la química del ion de clorito, tiene una geometría molecular doblada debido al efecto de los pares de electrones solitarios en los átomos de cloro. El ángulo de enlace del enlace O-Cl-O es de aproximadamente 111 grados. Además, el clorito es el agente oxidante más fuerte entre otras oxianiones de cloro, dependiendo del potencial de media célula.
La aplicación más común de clorito es su sal de sodio (clorito de sodio) que es útil en el blanqueo de textiles, pulpa y papel debido a su naturaleza fuertemente oxidante. Sin embargo, no se está utilizando directamente y, en cambio, necesitamos generar la especie de dióxido de cloro neutro a través de la reacción con HCL.
Que es el cloruro?
El cloruro es el anión que tiene la fórmula química CL-. Este anión deriva de un átomo de cloro. Por lo general, un átomo de cloro consta de 17 electrones, y tiene una configuración de electrones inestable debido al relleno orbital incompleto. Por lo tanto, los átomos de cloro son muy reactivos y forman iones de cloruro al obtener un electrón desde el exterior. Este electrón entrante ocupa el orbital más externo del átomo de cloro. Pero no hay suficientes cargas positivas en el núcleo de cloro para neutralizar la carga negativa de ese electrón. Por lo tanto, forma un anión llamado ion de cloruro. Un ejemplo común de un compuesto que contiene un ion de cloruro es la sal de la mesa o el cloruro de sodio.
El ion cloruro tiene 18 electrones. La configuración de electrones es similar a la de un átomo de argón. Es menos reactivo y su electronegatividad también es muy menor. Tiende a repeler cualquier otro electrón entrante debido a su carga negativa.
Los compuestos que contienen iones de cloruro generalmente se llaman cloruros. La mayoría de estos cloruros son solubles en agua. Cuando estos compuestos se disuelven en agua, el anión y el catión se separan entre sí. Dado que estos iones son iones cargados eléctricamente, una solución compuesta de iones de cloruro y cualquier otro catión puede realizar una corriente eléctrica a través de la solución.
Diferencia entre clorito y cloruro
El clorito y el cloruro son aniones derivados de átomos de cloro. El clorito es un anión que tiene la fórmula química clo2- mientras que el cloruro es el anión que tiene la fórmula química CL-. El clorito es un oxianión y contiene átomos de oxígeno aparte del cloro. La diferencia clave entre el clorito y el cloruro es que el ion de clorito es un agente fuertemente oxidante, mientras que el cloruro no es un agente oxidante, pero puede actuar como un agente reductor.
A continuación se muestra un resumen de la diferencia entre clorito y cloruro en forma tabular.
Resumen -Clorito vs cloruro
El clorito y el cloruro son aniones derivados de átomos de cloro. La diferencia clave entre el clorito y el cloruro es que el ion de clorito es un agente fuertemente oxidante, mientras que el cloruro no es un agente oxidante.
Referencia:
1. "Halógenos como agentes oxidantes." Bibliotecas de química, Bibliotecas.
Imagen de cortesía:
1. "CLORICIÓN" de Eschenmoser - trabajo propio usando: ChemDraw 8.0 (dominio público) a través de Commons Wikimedia


