Diferencia entre cloroformo y tetracloruro de carbono
El diferencia clave entre cloroformo y tetrloruro de carbono es que el cloroformo (CHCL3) es un potente anestésico, pero tetracloruro de carbono (CCL4) no es un anestésico.
Además, tanto el cloroformo como el tetracloruro de carbono tienen la misma geometría química; geometría tetraédrica. Dado que la estructura química y la composición del tetracloruro de carbono se asemejan a la cloroformo, la mayoría de las personas malinterpretan que ambos son los mismos. Sin embargo, el tetracloruro de carbono solo tiene átomos de carbono y cloro, mientras que el cloroformo tiene átomos de carbono, cloro e hidrógeno.
CONTENIDO
1. Descripción general y diferencia de claves
2. Que es el cloroformo
3. ¿Qué es el tetracloruro de carbono?
4. Comparación de lado a lado: cloroformo vs tetracloruro de carbono en forma tabular
5. Resumen
Que es el cloroformo?
El cloroformo es chcl3 , que se usa como un anestésico poderoso. El nombre IUPAC de este compuesto es triclorometano. Es un líquido incoloro y denso que tiene un olor dulce. El propósito de la producción a gran escala de este compuesto es como precursor para producir PTFE. La mayor parte del cloroformo en el medio ambiente (aproximadamente 90%) se debe a las emisiones de origen natural. Ej: muchos tipos de algas y hongos producen este compuesto.
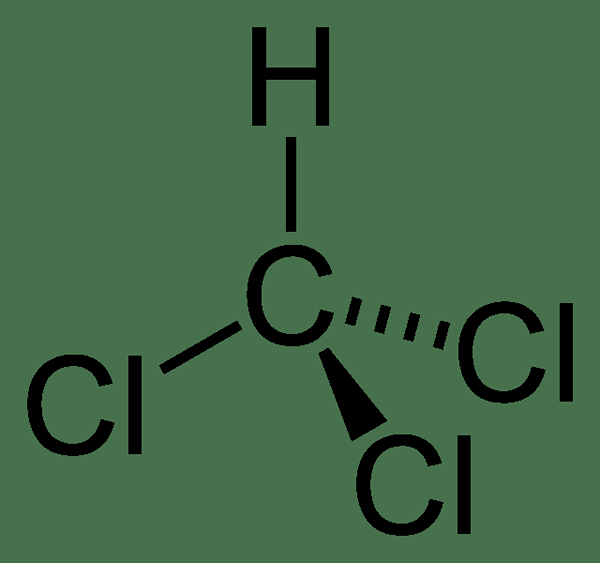
La masa molar del compuesto es 119.37 g/mol, y aparece como un líquido incoloro a temperatura ambiente. Tiene un olor etéreo pesado. El punto de fusión es −63.5 ° C, y el punto de ebullición es 61.15 ° C. Además, se descompone a 450 ° C. La molécula de cloroformo tiene una geometría tetraédrica.

Figura 01: Estructura química del cloroformo
En escala industrial, podemos producir este compuesto mediante el calentamiento de una mezcla de cloro y clorometano (o a veces también usamos metano). Al calentar, se produce una halogenación de radicales libres a 400-500 ° C. Allí, los compuestos clorados de clorometano (o metano) se forman que producen cloroformo. Allí, este compuesto puede sufrir más cloración, formando tetracloruro de carbono. Sin embargo, el producto final de esta reacción es una mezcla de clorometanos que podemos separar a través de la destilación para obtener cloroformo.
Hay muchos usos de cloroformo. Es útil como disolvente porque el átomo de hidrógeno en esta molécula puede sufrir un enlace de hidrógeno. Podemos usarlo como reactivo para muchas reacciones químicas también. Ej: Como fuente de grupo de diclorocarbeno. Más importante aún, el cloroformo es conocido por sus propiedades anestésicas.
¿Qué es el tetracloruro de carbono??
El tetracloruro de carbono es CCL4 , que comúnmente llamamos "tetraclorometano". Es un líquido incoloro que tiene un olor dulce. Podemos detectarlo de su olor incluso a niveles bajos. En la industria de la limpieza, el nombre común de este compuesto es el tet de carbono.
La masa molar es 153.81 g/mol. El punto de fusión es −22.92 ° C, y el punto de ebullición es 76.72 ° C. La geometría de esta molécula es la geometría tetraédrica. Dado que tiene cuatro átomos de cloro unidos a un solo átomo de carbono, los ángulos de enlace de las moléculas son iguales. Lo llamamos una "geometría simétrica". Debido a esta geometría, el compuesto no es polar. Se asemeja a la estructura de la molécula de metano que tiene cuatro átomos de hidrógeno unidos a un solo átomo de carbono.
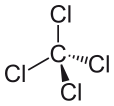
Figura 02: Estructura química del tetracloruro de carbono
Hay muchos usos del tetracloruro de carbono. Antes de la prohibición, este compuesto se usó para producir CFC a gran escala. Hoy en día, no producimos CFC ya que perjudica la capa de ozono. El tetracloruro de carbono es el ingrediente clave en las lámparas de lava. Una vez que fue un solvente popular, pero ahora no lo usamos debido a sus efectos adversos para la salud. Además, lo usamos ampliamente en extintores de incendios, como precursor de los refrigerantes y como agente de limpieza.
¿Cuál es la diferencia entre cloroformo y tetracloruro de carbono??
El cloroformo es chcl3 y es útil como un anestésico poderoso. El tetracloruro de carbono es CCL4, que comúnmente llamamos "tetraclorometano" no es un anestésico. Esta es la diferencia clave entre el cloroformo y el tetracloruro de carbono. Además, según la estructura molecular, el cloroformo tiene cinco átomos; Un átomo de carbono, un átomo de hidrógeno y tres átomos de cloro, y la geometría molecular es la geometría asimétrica tetraédrica. Pero, aunque el tetracloruro de carbono también tiene cinco átomos, tiene un átomos de carbono y cuatro átomos de cloro, y la geometría molecular es geometría simétrica tetraédrica. Además, considerando sus propiedades, la masa molar de cloroformo es 119.37 g/mol. Aparece como un líquido incoloro denso y tiene un olor etéreo pesado. Mientras que la masa molar de tetracloruro de carbono es 153.81 g/mol. Aparece como un líquido incoloro y tiene un olor dulce. La siguiente infografía presenta más detalles sobre la diferencia entre cloroformo y tetracloruro de carbono en forma tabular.
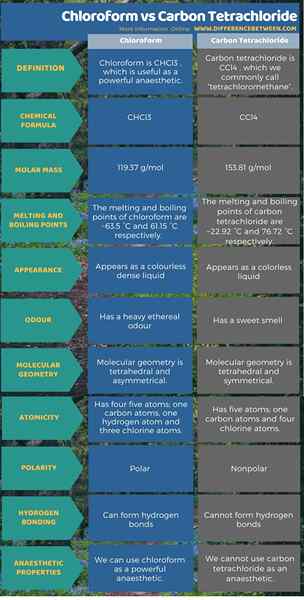
Resumen -cloroformo vs tetracloruro de carbono
Dado que tanto el cloroformo como el tetracloruro de carbono se parecen en su estructura y composición química, la mayoría de las personas los malinterpretan como el mismo compuesto. Pero, el tetracloruro de carbono solo tiene átomos de carbono y cloro, mientras que el cloroformo tiene átomos de carbono, cloro e hidrógeno. Además, la diferencia clave entre el cloroformo y el tetracloruro de carbono es que podemos usar el cloroformo como un anestésico poderoso, pero no podemos usar tetracloruro de carbono como anestesia.
Referencia:
1. "Cloroformo."Centro Nacional de Información de Biotecnología. Base de datos de compuestos de pubChem, u.S. Biblioteca Nacional de Medicina. Disponible aquí
2. "Tetracloruro de carbono."Centro Nacional de Información de Biotecnología. Base de datos de compuestos de pubChem, u.S. Biblioteca Nacional de Medicina. Disponible aquí
Imagen de cortesía:
1."Cloroformo que se muestra" por Benjah-BMM27, vectorizado por Fvasconcellos (dominio público) a través de Commons Wikimedia
2."Tetrachlormethan" por Neurotiker (charla) - trabajo propio, (dominio público) a través de Commons Wikimedia


