Diferencia entre los isómeros cis y trans
El diferencia clave entre los isómeros cis y trans es que el El isómero cis tiene los mismos átomos en el mismo lado del doble enlace, mientras que el isómero trans tiene dos de los mismos átomos en los lados opuestos del doble enlace.
Los isómeros son compuestos diferentes con la misma fórmula molecular. Hay varios tipos de isómeros. Pero, podemos dividir principalmente a los isómeros en dos grupos como isómeros y estereoisómeros constitucionales. Aquí, los isómeros constitucionales son isómeros donde la conectividad de los átomos difiere en las moléculas. En los estéreo, los átomos se conectan en la misma secuencia, a diferencia de los isómeros constitucionales. Por lo tanto, los estereoisómeros difieren solo en la disposición de sus átomos en el espacio. Además, los estereoisómeros son de dos tipos; enantiómeros y diastereómeros. Además, los isómeros cis y trans son las dos formas de diastereómeros.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué son los isómeros cis?
3. ¿Qué son los isómeros trans?
4. Comparación de lado a lado: cis vs trans trans en forma tabular
5. Resumen
¿Qué son los isómeros cis??
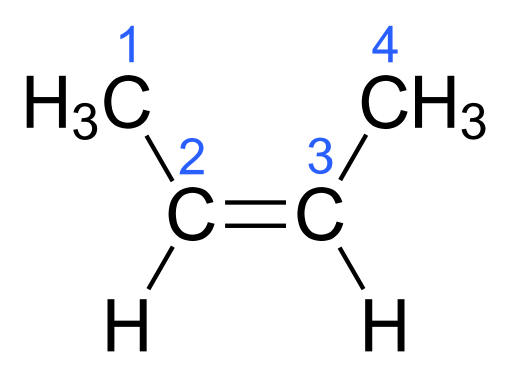
La molécula en la que dos de los mismos átomos están en el mismo lado del doble enlace es un isómero cis. El isómero cis tiene un punto de ebullición más alto en comparación con el isómero trans. La razón de esto es las fuerzas intermoleculares más fuertes en los isómeros cis.

Figura 01: Isómero cis de Butene
Por ejemplo, en 1,2-dicloroetano, cuando la molécula es cis, dos átomos de cloro electronegativos más están en un lado de la molécula. Debido a esto, ese lado de la molécula tendrá una ligera carga negativa, mientras que el otro lado tendrá una ligera carga positiva. Por lo tanto, la molécula se convierte en una interacción polar y dipolo-dipolo puede ocurrir entre las moléculas. Estas fuerzas intermoleculares adicionales en el isómero cis le dan un punto de ebullición más alto en comparación con los isómeros trans.
¿Qué son los isómeros trans??
Una molécula con dos de los mismos átomos en el lado opuesto del doble enlace es el isómero trans. Los isómeros trans tendrán puntos de ebullición más bajos porque, aunque hay una separación de carga, la molécula general se vuelve no polar.
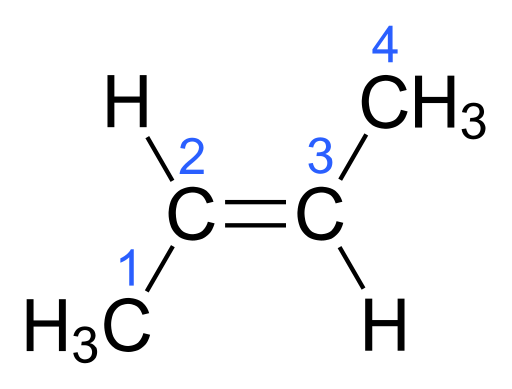
Figura 02: Trans Isómero de Butene
Sin embargo, los isómeros trans tienen un punto de fusión más alto. Los isómeros trans tienen una forma más recta y empacan bien. Por lo tanto, requiere una mayor energía para derretir la molécula que le da un punto de fusión más alto.
¿Cuál es la diferencia entre los isómeros cis y trans??
La molécula en la que dos de los mismos átomos están en el mismo lado del doble enlace se conoce como el isómero cis. Por otro lado, una molécula con dos de los mismos átomos en los lados opuestos del doble enlace se conoce como Trans Isomer. Por lo tanto, esta es la diferencia clave entre los isómeros cis y trans. Además, al comparar sus propiedades, podemos identificar alguna diferencia entre los isómeros cis y trans. Los isómeros cis son polares, mientras que los isómeros trans son relativamente no polares. Por lo tanto, el isómero cis tiene el punto de ebullición más alto en comparación con el del isómero trans. Sin embargo, los isómeros trans tienen un punto de fusión más alto; En contraste, las moléculas cis tienen un punto de fusión más bajo. Esto se debe principalmente a que las moléculas trans están empacadas bien que las moléculas cis.
La siguiente infografía presenta la diferencia entre los isómeros cis y trans en forma tabular.
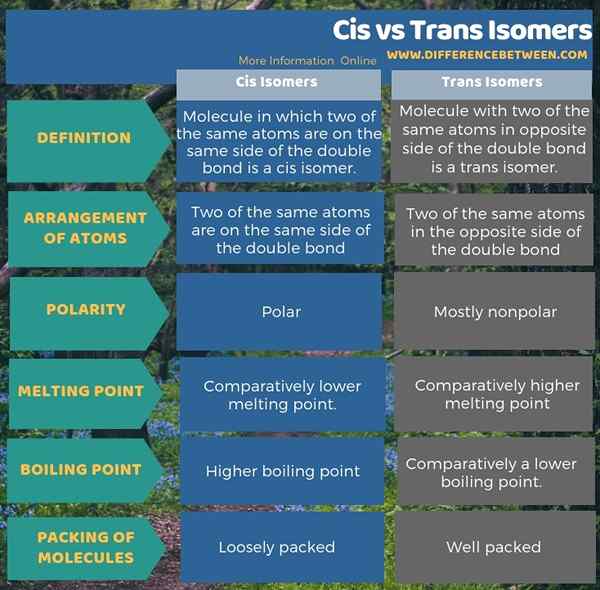
Resumen - cis vs trans isómeros
En resumen, los isómeros cis y trans son diastereómeros que se encuentran bajo los estereoisómeros. Y, la diferencia clave entre los isómeros cis y trans es que el isómero cis tiene los mismos átomos en el mismo lado del doble enlace, mientras que el isómero trans tiene dos de los mismos átomos en los lados opuestos del doble enlace.
Referencia:
1. "Isomerismo cis-trans."Wikipedia, Fundación Wikimedia, 11 de junio de 2018. Disponible aquí
Imagen de cortesía:
1."Cis-2-butene" de Jaga-trabajo propio, (CC By-SA 3.0) a través de Commons Wikimedia
2."Trans-2-butene" por Jaga-Trabajo propio, (CC By-SA 3.0) a través de Commons Wikimedia


