Diferencia entre la carbocatión clásica y no clásica
La diferencia clave entre la carbocatión clásica y no clásica es que Las carbocataciones clásicas tienen un átomo de carbono que tiene seis electrones en tres enlaces químicos, mientras que las carbocataciones no clásicas tienen una estructura de dos electrones de tres centros.
Una carbocatión es una especie química que es un resto de una molécula orgánica. Tiene una carga positiva en un átomo de carbono. Un ejemplo simple de una carbocatión es CH3+. Algunas carbocataciones tienen más de una carga positiva, en el mismo átomo de carbono o un átomo diferente. Además, las carbocaciones son intermedios reactivos en reacciones orgánicas debido a la presencia de una carga positiva; Hay seis electrones en un átomo de carbono, lo que lo hace inestable (la presencia de ocho electrones asegura la estabilidad); Por lo tanto, tiende a buscar electrones.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es la carbocatión clásica?
3. ¿Qué es la carbocatión no clásica?
4. Comparación lado a lado: carbocatión clásica frente a no clásica en forma tabular
5. Resumen
¿Qué es la carbocatión clásica??
Una carbocatión clásica es un ion que contiene un átomo de carbono cargado positivamente que tiene seis electrones que participan en tres enlaces químicos. Podemos nombrar este átomo de carbono como un carbono positivo de tres coordenadas.
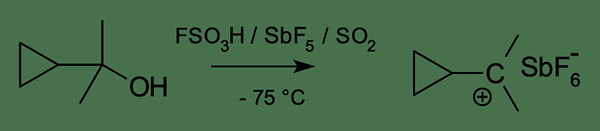
Figura 01: Formación de una carbocatión clásica
Para garantizar la máxima estabilidad, el átomo de carbono debe tener ocho electrones de valencia. Pero en la carbocatión, solo hay seis electrones en el átomo de carbono que tienen una carga positiva. Por lo tanto, tiende a compartir dos electrones más de una especie electronegativa. Esto hace que el átomo de carbono estable y neutralice la carga positiva. Esta es la razón de la alta reactividad de las carbocaciones clásicas. Sin embargo, la energía de una carbocatión clásica es baja en comparación con la energía de la carbocatión no clásica correspondiente. Pero esta diferencia en sus energías es muy pequeña.
¿Qué es la carbocatión no clásica??
Una carbocatión no clásica es un ion que contiene un carbono cargado positivamente en un centro de dos electrones de tres centros. Esto significa que hay tres átomos compartiendo dos electrones en estas carbocataciones. Este tipo de intercambio de electrones se nombra como delocalización de los electrones.

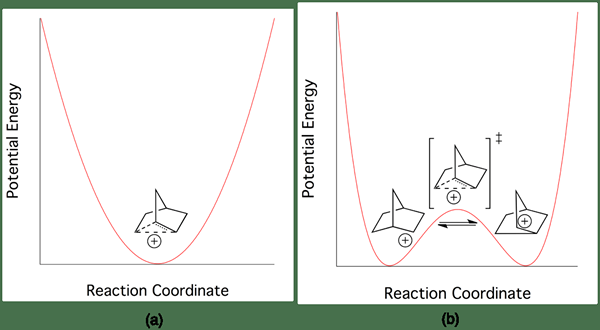
Figura 02: Diferencia de energía entre carbocataciones clásicas y no clásicas
El ejemplo más común de una carbocatión no clásica es el catión 2-norbornyl. Existe en una estructura de dos electrones de tres centros menos simétrica. Hay muy poca diferencia en la energía entre las carbocaciones clásicas y no clásicas. Por lo tanto, es muy difícil distinguirlos experimentalmente.
¿Cuál es la diferencia entre la carbocatión clásica y no clásica??
Podemos clasificar las carbocataciones en dos grupos como carbocataciones clásicas y no clásicas, dependiendo de la estructura química. La diferencia clave entre la carbocatión clásica y no clásica es que las carbocataciones clásicas tienen un átomo de carbono que tiene seis electrones en tres enlaces químicos, mientras que las carbocataciones no clásicas tienen una estructura de dos electrones de tres centros. La energía de la carbocatión no clásica es mayor que la energía de la carbocatión clásica, pero la diferencia entre estas energías es muy pequeña; Por lo tanto, es muy difícil distinguir la diferencia entre las estructuras clásicas y no clásicas.
Además, la energía de activación para la conversión de la carbocatión clásica en una carbocatión no clásica o viceversa es muy pequeña. Además de estos, las carbocataciones clásicas tienen la carga positiva en el átomo de carbono y el electrones Nod se combina alrededor del átomo de carbono, pero en las carbocataciones no clásicas, los electrones se deslocalizan alrededor del átomo de carbono. Un ejemplo de una carbocatión clásica es el ion de metenio, mientras que un ejemplo para una carbocatión no clásica es el ion 2-norboryl.

Resumen - carbotación clásica vs no clásica
Podemos clasificar las carbocataciones en dos grupos como carbocataciones clásicas y no calcsssicales, dependiendo de la estructura química. La diferencia clave entre la carbocatión clásica y no clásica es que las carbocataciones clásicas tienen un átomo de carbono que tiene seis electrones en tres enlaces químicos, mientras que las carbocataciones no clásicas tienen una estructura de dos electrones de tres centros. Un ejemplo de carbocatión clásica es el ion metenio, mientras que un ejemplo de una carbocatión no clásica es el ion 2-norboryl.
Referencia:
1. "Carbocaciones."Bibliotecas de química, 5 de junio de 2019, disponible aquí.
2. "Carbocation". Wikipedia.Org, 2019, disponible aquí.
Imagen de cortesía:
1. "El catión ciclopropil carbinilo" por V8RIK en English Wikipedia (CC BY-SA 3.0) a través de Commons Wikimedia
2. "Norbornyl Cation Single Well vs Double Well Potencial" por JCAL730 - Trabajo propio (dominio público) a través de Commons Wikimedia


