Diferencia entre el sistema cerrado y el sistema abierto
El diferencia clave entre el sistema cerrado y el sistema abierto es que En un sistema cerrado, el asunto no se intercambia con los alrededores, pero los intercambios de energía con los alrededores, mientras que en un sistema abierto, tanto la materia como los intercambios de energía con los alrededores.
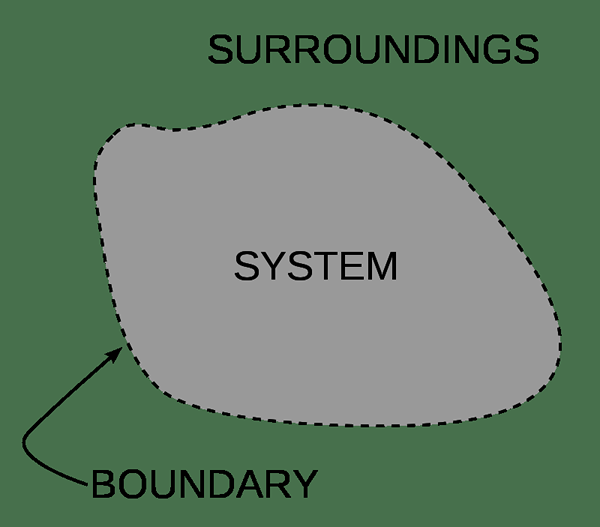
Para el propósito de la química, podemos dividir el universo en dos partes; "Sistema" y "El entorno". Un sistema puede ser un organismo, un recipiente de reacción o incluso una sola célula. Hay límites entre un sistema y los alrededores. El alcance del sistema depende de estos límites. A veces las cosas y los intercambios de energía a través de estos límites. Podemos distinguir los sistemas por el tipo de interacciones que tienen o por los tipos de intercambios tienen lugar. Además, podemos clasificar estos sistemas en dos como sistemas abiertos y sistemas cerrados.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es un sistema cerrado?
3. ¿Qué es un sistema abierto?
4. Comparación lado a lado: sistema cerrado frente al sistema abierto en forma tabular
5. Resumen
¿Qué es un sistema cerrado??
Si la materia no se transfiere a través del límite, entonces llamamos a ese tipo de sistema como un sistema cerrado. Sin embargo, en un sistema cerrado intercambios de energía con los alrededores. El asunto dentro de un sistema cerrado es siempre el mismo. Cuando ocurre una reacción, el sistema puede expandirse, o puede transferir energía al entorno si está a una temperatura más baja. Por ejemplo, cuando hay un fluido comprimido en un pistón, es un sistema cerrado. Allí la masa del fluido no cambia, pero el volumen puede cambiar.

Figura 01: Sistema y su límite en contacto con los alrededores
Un sistema aislado también es un sistema cerrado. Sin embargo, difiere de un sistema cerrado, porque el sistema aislado no tiene contacto mecánico ni térmico con sus alrededores. Con el tiempo, los sistemas aislados alcanzan el equilibrio termodinámico al equilibrar la presión, la temperatura u otras diferencias.
¿Qué es un sistema abierto??
En un sistema abierto, la materia y la energía se transfieren a través del límite entre el sistema y los alrededores. Como está abierto, interactúa continuamente con los alrededores. Por ejemplo, nuestro cuerpo es un sistema abierto. Es difícil controlar el flujo de energía dentro y fuera de un sistema abierto. Además, el equilibrio energético también es difícil. Como está abierto, la masa del sistema no es necesariamente constante; más bien su volumen es constante.
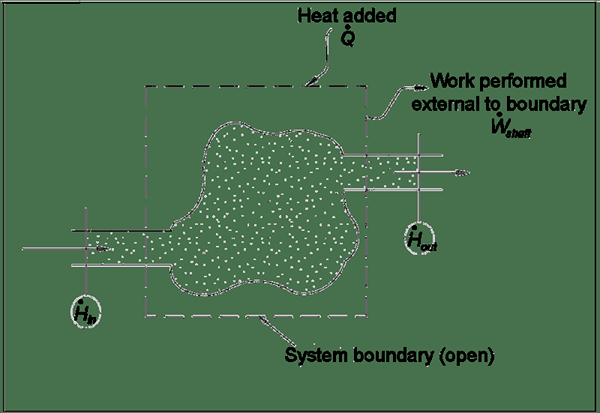
Figura 01: Primera ley de la termodinámica: sistema abierto
La primera ley de la termodinámica se relaciona con los sistemas abiertos. Establece sobre la energía interna de un sistema abierto. Podemos cambiar la energía interna de un sistema, ya sea trabajando en el sistema o calentando. El cambio en la energía interna de un sistema abierto es igual a la cantidad de energía que necesitamos agregar al sistema (mediante la calefacción o el trabajo) menos la cantidad perdida por la materia que fluye y la pérdida de energía debido al trabajo fue realizado por el trabajo por el trabajo por el trabajo. sistema.
¿Cuál es la diferencia entre el sistema cerrado y el sistema abierto??
Si el asunto no se transfiere a través del límite, entonces ese tipo de sistema es un sistema cerrado. Mientras que, en un sistema abierto, tanto la materia como la energía se transfieren a través del límite entre el sistema y el circundante. Por lo tanto, la diferencia clave entre el sistema cerrado y el sistema abierto es que los sistemas cerrados no permiten ningún intercambio de materia entre el sistema y los alrededores, mientras que el sistema abierto permite los intercambios de la materia. Además, otra diferencia entre el sistema cerrado y el sistema abierto es que los sistemas cerrados tienen una masa constante, mientras que los sistemas abiertos tienen una masa variable.
Además, también existe una diferencia entre el sistema cerrado y el sistema abierto para controlar los factores. Es decir, a diferencia del sistema cerrado, en un sistema abierto es difícil controlar el flujo de energía y otros parámetros.
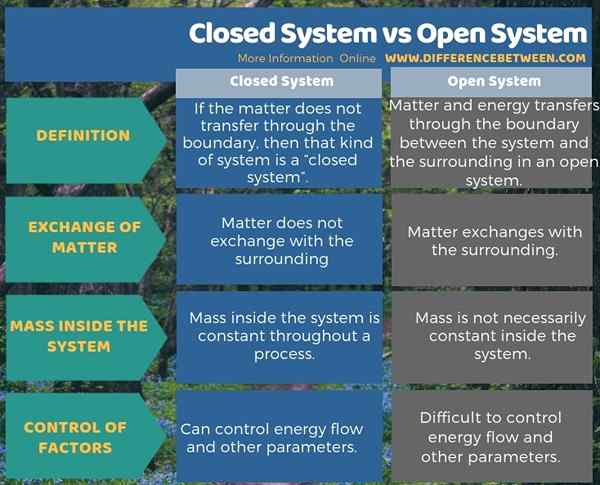
Resumen -Sistema cerrado vs Sistema abierto
Un sistema es una parte que ocurre en los alrededores. Existen diferentes tipos de contactos entre el sistema y los alrededores. En consecuencia, hay dos sistemas; un sistema abierto y un sistema cerrado. La diferencia clave entre el sistema cerrado y el sistema abierto es que en un sistema cerrado, el asunto no se intercambia con los alrededores, sino que los intercambios de energía con los alrededores, mientras que en un sistema abierto, tanto la materia como los intercambios de energía con los alrededores.
Referencia:
1. Bibliotecas. "Un sistema y su entorno."Bibliotecas de química, Librettexts, 21 de julio de 2016. Disponible aquí
Imagen de cortesía:
1."Límite del sistema" de Wavesmikey, rastreado por Stannered (dominio público) a través de Commons Wikimedia
2."First Law Open System" (dominio público) a través de Commons Wikimedia


