Diferencia entre las propiedades coligativas de los electrolitos y los no electrolitos
Diferencia clave - Colegativo Propiedades de electrolitos vs no electrolitos
Las propiedades de colegación son propiedades físicas de una solución que depende de la cantidad de un soluto pero no de la naturaleza del soluto. Esto significa que cantidades similares de solutos completamente diferentes pueden alterar estas propiedades físicas en cantidades similares. Por lo tanto, las propiedades de coligeración dependen de la relación de la cantidad de soluto y la cantidad de solvente. Las tres principales propiedades de coligeración son la disminución de la presión del vapor, la elevación del punto de ebullición y la depresión del punto de congelación. Para una relación de masa soluto-solvente dada, todas las propiedades de coligeración son inversamente proporcionales a la masa molar de soluto. Los electrolitos son sustancias que pueden formar soluciones que pueden realizar electricidad a través de esta solución. Dichas soluciones se conocen como soluciones electrolíticas. Los no electrolitos son sustancias que no son capaces de formar soluciones electrolíticas. Ambos tipos (electrolitos y no electrolitos) tienen propiedades de coligeración. El diferencia clave Entre las propiedades coligativas de los electrolitos y los no electrolitos es que El efecto de los electrolitos en las propiedades de coligeración es muy alto en comparación con el de los no electrolitos.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Cuáles son las propiedades de coligeración de los electrolitos?
3. ¿Cuáles son las propiedades coligativas de los no electrolitos?
4. Comparación de lado a lado: propiedades de coligeración de electrolitos frente a no electrolitos en forma tabular
5. Resumen
¿Cuáles son las propiedades de coligeración de los electrolitos??
Las propiedades coligativas de los electrolitos son las propiedades físicas de las soluciones electrolíticas que dependen de la cantidad de solutos independientemente de la naturaleza de los solutos. Los solutos presentes en las soluciones electrolíticas son átomos, moléculas o iones que han perdido o ganado electrones para ser conductores eléctricamente.
Cuando un electrolito se disuelve en un disolvente como el agua, el electrolito se separa en iones (o cualquier otra especie conductora). Por lo tanto, disolver un mol de electrolito siempre produce dos o más lunares de especies conductoras. Por lo tanto, las propiedades coligativas de los electrolitos están cambiando considerablemente cuando un electrolito se disuelve en un solvente.
Por ejemplo, la ecuación general utilizada para describir los cambios en el punto de congelación y el punto de ebullición es la siguiente,
Δtb = Kbmy ΔtF = KFmetro
Δtb es la elevación del punto de ebullición y ΔtF es la depresión del punto de congelación. Kb y kF son constantes de elevación del punto de ebullición y la depresión del punto de congelación constante respectivamente. m es la molaridad de la solución. Para las soluciones electrolíticas, las ecuaciones anteriores se modifican de la siguiente manera,
Δtb = ikbmetro y ΔtF = ikFmetro
"I" es un multiplicador de iones conocido como factor Van't Hoff. Este factor es igual al número de moles de iones dados por un electrolito. Por lo tanto, el factor Van't Hoff se puede determinar al encontrar el número de iones liberados por un electrolito cuando se disuelve en un solvente. Por ejemplo, el valor del factor Van't Hoff para NaCl es 2 y en CaCl2, Es 3.

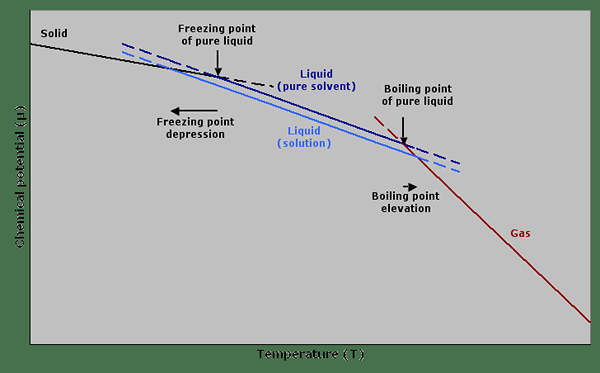
Figura 01: Un gráfico que muestra el potencial químico contra la temperatura que describe la depresión del punto de congelación y la elevación del punto de ebullición
Sin embargo, los valores dados para estas propiedades de colección son diferentes de los valores predichos teóricamente. Esto se debe a que puede haber interacciones soluto y solvente que reducen el efecto de los iones en esas propiedades.
Las ecuaciones anteriores se modifican para ser utilizadas para electrolitos débiles. Los electrolitos débiles se disocian parcialmente en iones, por lo tanto, algunos de los iones no afectan las propiedades de coligeración. El grado de disociación (α) de un electrolito débil se puede calcular de la siguiente manera,
α = (i-1)/(N-1) x 100
Aquí, n es el número máximo de iones formados por molécula del electrolito débil.
¿Cuáles son las propiedades coligativas de los no electrolitos??
Las propiedades coligativas de los no electrolitos son las propiedades físicas de las soluciones no electrolíticas que dependen de la cantidad de solutos independientemente de la naturaleza de los solutos. Los no electrolitos son sustancias que no crean soluciones conductoras cuando se disuelven en un solvente. Por ejemplo, el azúcar no es un electrolito porque cuando el azúcar se disuelve en agua, existe en forma molecular (no se disocia en iones). Estas moléculas de azúcar son incapaces de realizar corrientes eléctricas a través de la solución.
El número de solutos presentes en una solución no electrolítica es menos en comparación con una solución electrolítica. Por lo tanto, el efecto de los no electrolitos en las propiedades de coligeración también es muy bajo. Por ejemplo, el grado de disminución de la presión de vapor al agregar NaCl es mayor en comparación con la adición de azúcar a una solución similar.
¿Cuál es la diferencia entre las propiedades coligativas de los electrolitos y los no electrolitos??
Propiedades de coligeración de electrolitos vs no electrolitos | |
| Las propiedades coligativas de los electrolitos son las propiedades físicas de las soluciones electrolíticas que dependen de la cantidad de solutos independientemente de la naturaleza de los solutos. | Las propiedades coligativas de los no electrolitos son las propiedades físicas de las soluciones no electrolíticas que dependen de la cantidad de solutos independientemente de la naturaleza de los solutos. |
| Solutos | |
| Los electrolitos proporcionan más solutos a la solución a través de la disociación; Por lo tanto, las propiedades de coligeración se cambian considerablemente. | Los no electrolitos proporcionan un bajo soluto a la solución ya que no hay disociación; Por lo tanto, las propiedades de coligeración no se cambian considerablemente. |
| Efecto sobre las propiedades coligantes | |
| El efecto de los electrolitos en las propiedades de coligeración es muy alto en comparación con los no electrolitos. | El efecto de los no electrolitos en las propiedades de coligeración es muy bajo en comparación con los electrolitos. |
Resumen - Colegativo Propiedades de electrolitos vs no electrolitos
Las propiedades coligativas son propiedades físicas de soluciones que no dependen de la naturaleza de un soluto sino de la cantidad de solutos. La diferencia entre las propiedades coligativas de los electrolitos y los no electrolitos es que el efecto de los electrolitos en las propiedades de coligeración es muy alto en comparación con los no electrolitos.
Referencia:
1."5.9: Propiedades de coligeración de las soluciones de electrolitos."Bibliotecas de química, Librettexts, 21 de julio de 2016. Disponible aquí
2."Propiedades coligativas."Wikipedia, Fundación Wikimedia, 10 Mar. 2018. Disponible aquí
3.Britannica, los editores de Encyclopedia. "Electrólito."Encyclopædia Britannica, Encyclopædia Britannica, Inc., 7 de junio de 2017. Disponible aquí
Imagen de cortesía:
1.'La depresión del punto de congelación y la elevación del punto de ebullición' por tomas er - trabajo propio, (cc by -sa 3.0) a través de Commons Wikimedia


