Diferencia entre la teoría de colisión y la teoría del estado de transición
Diferencia clave: colisión Teoría VS Teoría del estado de transición
La teoría de la colisión y la teoría del estado de transición son dos teorías que se utilizan para explicar las tasas de reacción de diferentes reacciones químicas a nivel molecular. La teoría de la colisión describe las colisiones de las moléculas de gas en reacciones químicas en fase gaseosa. La teoría del estado de transición explica las tasas de reacción asumiendo la formación de compuestos intermedios que son estados de transición. El diferencia clave entre la teoría de colisión y la teoría del estado de transición es que La teoría de la colisión se relaciona con las colisiones entre las moléculas de gas, mientras que la teoría del estado de transición se relaciona con la formación de compuestos intermedios en los estados de transición.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es la teoría de la colisión?
3. ¿Qué es la teoría del estado de transición?
4. Comparación de lado a lado - Teoría de la colisión vs Teoría del estado de transición en forma tabular
5. Resumen
¿Qué es la teoría de la colisión??
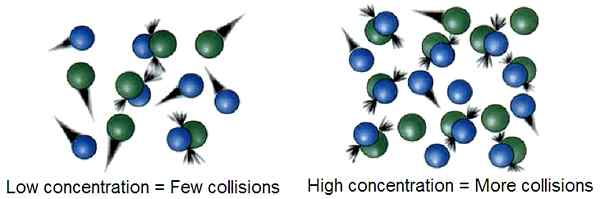
La teoría de la colisión explica que las reacciones químicas en fase gaseosa ocurren cuando las moléculas chocan con suficiente energía cinética. Esta teoría se basa en la teoría cinética de los gases (la teoría cinética de los gases describe que los gases contienen partículas que no tienen volúmenes definidos sino con masas definidas y no hay atracciones intermoleculares o repulsiones entre estas partículas de gases).

Figura 01: Si hay muchas partículas de gas en un pequeño volumen, entonces la concentración es alta, entonces la probabilidad de chocar dos partículas de gas es alta. Esto da como resultado una gran cantidad de colisiones exitosas
Según la teoría de la colisión, solo unas pocas colisiones entre las partículas de gas hacen que estas partículas experimenten reacciones químicas considerables. Estas colisiones se conocen como colisiones exitosas. La energía requerida para estas colisiones exitosas se conoce como energía de activación. Estas colisiones pueden causar rotura y formación de enlaces químicos.
¿Qué es la teoría del estado de transición??
La teoría del estado de transición indica que, entre el estado donde las moléculas son reactivos y el estado donde las moléculas son productos, existe un estado conocido como estado de transición. La teoría del estado de transición se puede utilizar para determinar las velocidades de reacción de las reacciones elementales. Según esta teoría, los reactivos, productos y compuestos de estado de transición están en equilibrio químico entre sí.
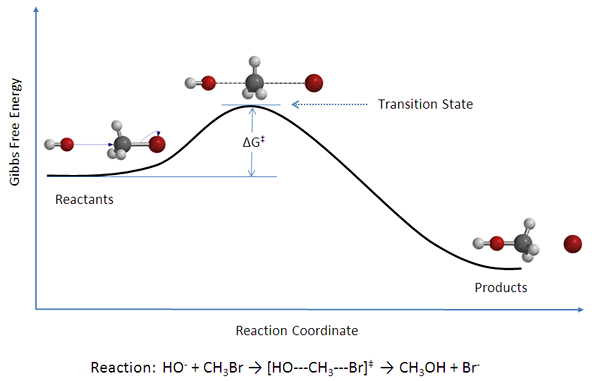
Figura 02: Un diagrama que muestra reactivos, productos y complejos de estado de transición
La teoría del estado de transición se puede utilizar para comprender el mecanismo de una reacción química elemental. Esta teoría es una alternativa más precisa al Ecuación de Arrhenius. Según la teoría del estado de transición, hay tres factores principales que afectan el mecanismo de una reacción;
- La concentración del compuesto del estado de transición (conocido como complejo activado)
- La tasa de desglose del complejo activado: esto determina la tasa de formación del producto deseado
- La forma del desglose del complejo activado: esto determina los productos formados en la reacción química
Sin embargo, según esta teoría, hay dos enfoques para una reacción química; El complejo activado puede volver a la forma del reactante, o puede romperse para formar productos (s) de productos). La diferencia de energía entre la energía reactiva y la energía del estado de transición se conoce como energía de activación.
¿Cuál es la diferencia entre la teoría de colisión y la teoría del estado de transición??
Teoría de la colisión vs teoría del estado de transición | |
| La teoría de la colisión explica que las reacciones químicas en fase gaseosa ocurren cuando las moléculas chocan con suficiente energía cinética. | La teoría del estado de transición indica que, entre el estado donde las moléculas son reactivos y el estado donde las moléculas son productos, existe un estado conocido como estado de transición. |
| Principio | |
| La teoría de la colisión establece que las reacciones químicas (en la fase gaseosa) ocurren debido a colisiones entre reactivos. | La teoría del estado de transición establece que las reacciones químicas ocurren a través de un estado de transición. |
| Requisitos | |
| Según la teoría de la colisión, solo las colisiones exitosas hacen que ocurran reacciones químicas. | Según la teoría del estado de transición, una reacción química progresará si los reactivos pueden superar la barrera de energía de activación. |
Resumen -Colisión Teoría VS Teoría del estado de transición
La teoría de la colisión y la teoría del estado de transición se utilizan para explicar las velocidades de reacción y los mecanismos de diferentes reacciones químicas. La diferencia entre la teoría de la colisión y la teoría del estado de transición es que la teoría de la colisión se relaciona con las colisiones entre las moléculas de gas, mientras que la teoría del estado de transición se relaciona con la formación de compuestos intermedios en los estados de transición.
Referencia:
1."Teoría de la colisión."Bibliotecas de química, Librettexts, 22 de mayo de 2017. Disponible aquí
2."Teoría del estado de transición."Wikipedia, Fundación Wikimedia, 28 de febrero. 2018. Disponible aquí
3."9.7: Teorías de las tasas de reacción."Bibliotecas de química, Librettexts, 21 de julio de 2016. Disponible aquí
Imagen de cortesía:
1.'Colisiones moleculares' por sadi_carnot (dominio público) a través de Commons Wikimedia
2.'Rxn Coordinate Diagram 5'by Chem540Grp1f08 - Trabajo propio, (CC By -SA 3.0) a través de Commons Wikimedia


