Diferencia entre la combinación y la reacción de descomposición

Diferencia clave: reacción de combinación vs descomposición
Una reacción química es la conversión de uno o más compuestos químicos en uno o más productos diferentes, cambiando la identidad de un compuesto químico. El material de partida de una reacción química se llama reactante y el compuesto resultante se llama producto. Desglose de compuestos o combinación de compuestos y formación de nuevos compuestos se producirá durante un proceso de reacción química ya que los enlaces entre los átomos del compuesto se rompen y se crean de una manera diferente. Las reacciones químicas se pueden dividir en varias categorías amplias. Las reacciones redox o las reacciones de reducción de oxidación son muy importantes entre ellas. Las reacciones de oxidación y reducción se denominan reacciones de transferencia de electrones ya que los electrones de reactivos se transfieren de un compuesto a otro para causar la reacción. En reacciones redox, dos reacciones paralelas, que se llaman medias reacciones, ocurren al mismo tiempo. Estas medias reacciones muestran la transferencia de electrones. Al equilibrar estas medias reacciones, uno puede adivinar la reacción general que ha sucedido al final. Las reacciones de combinación y las reacciones de descomposición son dos tipos principales de reacciones redox. La principal diferencia entre la combinación y la reacción de descomposición es que La reacción combinada implica una combinación de reactivos para dar un solo producto mientras La reacción de descomposición implica la desglose de un solo compuesto en dos o más productos.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es una reacción combinada?
3. ¿Qué es una reacción de descomposición?
4. Comparación de lado a lado - Reacción de combinación vs descomposición
5. Resumen
¿Qué es una reacción combinada??
Una reacción combinada, también llamada como reacción de síntesis, es una reacción en la que los compuestos reactivos se combinan para formar un compuesto diferente como el producto. En otras palabras, la reacción de moléculas simples da como resultado una molécula compleja. Algunos o todos los enlaces entre los átomos de ese compuesto en particular se descomponen; Al mismo tiempo, los átomos se combinarán para formar el nuevo compuesto, que es el producto. En las reacciones de descomposición, el mismo reactivo actúa que el material de partida para ambas reacciones. A diferencia de las reacciones de descomposición, las medias reacciones en las reacciones combinadas tienen diferentes reactivos para comenzar con. La reacción de combinación da como resultado un solo producto. El siguiente es un ejemplo común que se puede dar como reacciones de combustión.
Por ejemplo, cuando el aluminio (Al) se coloca en bromuro líquido (BR2) Se produce una reacción combinada y produce bromuro de aluminio (ALBR3). Aquí, el número de oxidación aumenta en Al y disminuye en BR. Por lo tanto, es una reacción redox y es una reacción combinada ya que dos reactivos han reaccionado para dar un producto en particular.
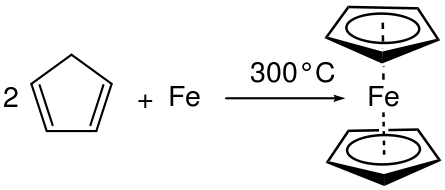
Figura 01: Reacción combinada
¿Qué es la reacción de descomposición??
La reacción de descomposición es otra reacción importante en la categoría de reacciones redox. Es básicamente lo opuesto a la reacción combinada. Una reacción de descomposición es una reacción donde el compuesto reactivo se descompone en productos. Aquí, las medias reacciones ocurren al mismo tiempo que la reacción de oxidación y la reacción de reducción. Pero a diferencia de la reacción combinada, el reactivo para ambas medias reacciones es el mismo en las reacciones de descomposición. La reacción de descomposición da como resultado varios productos.
En la electrólisis del agua, cuando la corriente continua se pasa a través del agua, las moléculas de agua se descomponen para dar oxígeno e gases de hidrógeno. Aquí, el número de oxidación aumenta en el átomo de oxígeno y disminuye en el átomo de hidrógeno. Por lo tanto, es una reacción redox y una reacción de descomposición debido a la descomposición de las moléculas de agua en gases de oxígeno e hidrógeno.

Figura 02: combinación vs descomposición
¿Cuál es la diferencia entre la combinación y la reacción de descomposición??
Reacción de combinación vs descomposición | |
| Dos o más compuestos reactivos están involucrados en reacciones de combinación. | Un solo compuesto está involucrado en una reacción de descomposición. |
| Productos | |
| La reacción de combinación da como resultado un solo producto. | Las reacciones de descomposición dan como resultado varios productos. |
| Medias reacciones | |
| En reacciones combinadas, dos medias reacciones tienen dos moléculas iniciales diferentes. | En las reacciones de descomposición, una sola molécula actúa como material de partida para ambas reacciones. |
| Enlaces químicos | |
| Las reacciones combinadas dan como resultado la unión de átomos para producir el producto de un solo extremo. | En las reacciones de descomposición, los enlaces químicos se descomponen para formar dos o más productos finales. |
| Moléculas | |
| Las reacciones combinadas hacen que las moléculas simples reaccionen y produzcan moléculas complejas. | Las reacciones de descomposición hacen que las moléculas complejas se descompongan en moléculas simples. |
Resumen -Reacción de combinación vs descomposición
Las reacciones redox son parte del mundo que nos rodea porque la mayoría de las reacciones químicas importantes son reacciones redox. Las reacciones combinadas y las reacciones de descomposición son reacciones simples que son opuestas entre sí. La principal diferencia entre la combinación y la reacción de descomposición es que la reacción combinada implica la combinación de dos o más moléculas reactivas para dar como resultado un solo producto final, mientras que la reacción de descomposición implica la descomposición de una sola molécula en dos o más productos.
Referencias:
1.Chang, R., 2010. química. 10ª ed. Newyork: McGraw-Hill.
2.Redox. (2009, 30 de julio). Consultado el 29 de mayo de 2017 de https: // weakinteracciones.WordPress.com/Primers/redox/
3.Reacciones. (norte.d.). Consultado el 29 de mayo de 2017 de http: // www.rico.edu/facultad/ptiskus/reacciones/
Imagen de cortesía:
1. "Miller Ferrocen Synthese" de Bert.Kilanowski - Trabajo propio (CC0) a través de Commons Wikimedia
2. "Reacciones químicas" de Daniele Pugliesi - Trabajo propio (CC By -SA 3.0) a través de Commons Wikimedia [recortado]


