Diferencia entre la ley de gas combinada y la ley de gas ideal
Diferencia clave: ley de gas combinada vs Ideal Ley de gas
Al estudiar sobre diferentes gases, las relaciones entre el volumen, la presión, la temperatura del gas y la cantidad de gas presente es muy importante. Estas relaciones son dadas por la ley de gas ideal y la ley de gas combinada. Al explicar estas leyes, el término "gas ideal" a menudo se usa. Un gas ideal no existe en la realidad, pero es un compuesto gaseoso hipotético. No tiene fuerzas intermoleculares entre las moléculas de gas. Sin embargo, algunos gases pueden comportarse como un gas ideal cuando se proporcionan condiciones adecuadas (temperatura y presión). Las leyes de gas se crean para gases ideales. Al usar estas leyes de gas para gases reales, se consideran algunas correcciones. La ley de gas combinada es una combinación de tres leyes de gas; La ley de Boyle, la ley de Charles y la ley de Gay-Lussac. El diferencia clave Entre la ley de gas combinada y la ley de gas ideal es el La ley de gas combinada es una colección de tres leyes de gas, mientras que la ley de gas ideal es una ley de gas individual.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es la ley de gas combinada?
3. ¿Qué es la ley de gas ideal?
4. Relación entre la ley de gas combinada y la ley de gas ideal
5. Comparación de lado a lado - Ley de gas combinada frente a la ley de gas ideal en forma tabular
6. Resumen
¿Qué es la ley de gas combinada??
La ley de gas combinada se forma a partir de la combinación de tres leyes de gas; La ley de Boyle, la ley de Charles y la ley de Gay-Lussac. Las leyes de gas combinadas indican que la relación del producto de presión y volumen y la temperatura absoluta de un gas es igual a una constante.
PV/T = K
En el que p es presión, v es volumen, t es temperatura y k es una constante. Cuando la ley de gas combinada se usa junto con la ley de Avogadro, resulta en la ley de gas ideal. La ley de gas combinada no tiene propietario ni descubridor. La relación anterior se puede dar como a continuación también.
P1V1/T1 = P2V2/T2
Esto da la relación entre volumen, temperatura y presión de un gas ideal en dos estados. Por lo tanto, esta ecuación se puede usar para explicar y predecir estos parámetros en un estado inicial o estado final.
Ley de Boyle
A temperatura constante, el volumen de un gas ideal es inversamente proporcional a la presión de ese gas. Esto significa que el producto de la presión inicial (P1) y el volumen inicial (V1) es igual al producto de la presión final (P2) y el volumen final (V2) del mismo gas.
P1V1 = P2V2
Ley de Charles
A presión constante, el volumen de un gas ideal es directamente proporcional a la temperatura de ese gas. Esta ley se puede dar a continuación.
V1/t1 = v2/t2
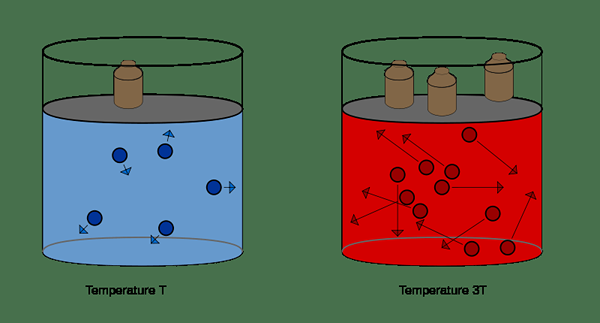
Figura 01: Ilustración de la ley de volumen de presión
Ley de Gay-Lussac
A volumen constante, la presión de un gas ideal es directamente proporcional a la temperatura del mismo gas. Esto se puede dar a continuación,
P1/T1 = P2/T2
¿Qué es la ley de gas ideal??
La ley de gas ideal es una ley fundamental en química, e indica que el producto de presión (p) y volumen (v) de un gas ideal es directamente proporcional al producto de la temperatura (t) y una serie de partículas de gas (( norte).
PV = KNT
Aquí, K es una constante de proporcionalidad. Se conoce como la constante de Boltzmann. Se encuentra que el valor de esta constante es 1.38 x 10-23 J/k. Sin embargo, el gas ideal se expresa simplemente de la siguiente manera.
PV = NRT
Donde n es el número de moles de gas presente, y r es la constante de gas universal dada por 8.314 JMOL-1K-1. Esta ecuación solo se puede usar para gases ideales. Si necesita usarse para gases reales, se realizan algunas correcciones porque los gases reales tienen muchas excepciones de gases ideales.
Esta nueva ecuación se conoce como ecuación de van der Waals. Se da como se muestra a continuación.
(P + a n/v2) (V/n - b) = rt
En esta ecuación, "A" es una constante que depende del tipo de gas y B también es una constante que da el volumen por mol de gas (ocupado por las moléculas de gas).
¿Cuál es la relación entre la ley de gas combinada y la ley de gas ideal??
- Cuando la ley de gas combinada se usa junto con la ley de Avogadro, resulta en la ley de gas ideal.
¿Cuál es la diferencia entre la ley de gas combinada y la ley de gas ideal??
Ley de gas combinada frente a la ley de gas ideal | |
| La ley de gas combinada se forma a partir de la combinación de tres leyes de gas; La ley de Boyle, la ley de Charles y la ley de Gay-Lussac. | La ley de gas ideal es una ley fundamental en química; Indica que el producto de la presión (P) y el volumen (v) de un gas ideal es directamente proporcional al producto de la temperatura (t) y una serie de partículas de gas (n). |
| Formación | |
| La ley de gas combinada está formada por la combinación de la ley de Boyle, la ley de Charles y la ley de Gay-Lussac. | La ley de gas ideal es una ley individual. |
| Ecuación | |
| La ley de gas combinada viene dada por PV/T = K | La ley de gas ideal viene dada por PV = NRT |
Resumen - Ley de gas combinada vs Ideal Ley de gas
Las leyes de gas se utilizan para comprender y predecir el comportamiento y las propiedades de un gas. La diferencia entre la ley de gas combinada y la ley de gas ideal es que la ley de gas combinada es una colección de tres leyes de gas, mientras que la ley de gas ideal es una ley de gas individual. La ley de gas combinada se forma a partir de la ley de Boyle, la ley de Charles y la ley de Gay-Lussac.
Referencia:
1.Helmenstine, Anne Marie. "Comprender la ley de gas combinada en química."THEWLECO. Disponible aquí
2.Helmenstine, Anne Marie. "¿Cuál es la ley de gas ideal?? Revise sus conceptos de química."THEWLECO. Disponible aquí
3."¿Cómo difiere la ley de gas ideal de la ley de gas combinada?? | Socrático."Org. Disponible aquí
Imagen de cortesía:
1.'Ley de presión de temperatura' por Egmason - Trabajo propio, (CC BY -SA 3.0) a través de Commons Wikimedia
2.'37147128632' por Travis Wise (CC por 2.0) a través de Flickr


