Diferencia entre la combustión completa e incompleta

El diferencia clave Entre la combustión completa e incompleta es que La combustión completa tiene lugar cuando hay un suministro de oxígeno constante y suficiente, mientras que se produce una combustión incompleta cuando no hay suficiente suministro de oxígeno.
Originalmente las reacciones de oxidación son las reacciones en las que participa el gas oxígeno. Allí, el oxígeno se combina con otra molécula, para producir un óxido. En esta reacción, el oxígeno sufre una reducción, y la otra sustancia sufre oxidación. Entonces, básicamente, la reacción de oxidación está agregando oxígeno a otra sustancia. Otra forma de describir la oxidación es la pérdida de hidrógeno. Hay algunas ocasiones en las que es difícil describir la oxidación como agregar oxígeno. Hay varios tipos de reacciones de oxidación. Algunos están sucediendo en el entorno natural diariamente. Ardor y combustión son algunas reacciones oxidantes donde los humanos involucran.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es la combustión completa?
3. ¿Qué es la combustión incompleta?
4. Comparación lado a lado: completa vs combustión incompleta en forma tabular
5. Resumen
¿Qué es la combustión completa??
La combustión o el calentamiento es una reacción que el calor produce a través de una reacción exotérmica. Es una reacción de oxidación. Para que la reacción tenga lugar, requiere combustible y un oxidante. Las sustancias que experimentan la combustión son los combustibles. Los ejemplos incluyen hidrocarburos como gasolina, diesel, metano o gas de hidrógeno, etc. Por lo general, el agente oxidante es oxígeno, pero algunos otros oxidantes como el flúor también pueden actuar como agentes oxidantes.

Figura 01: Llama durante la combustión completa
En la reacción, el oxidante oxida el combustible. Entonces esta es una reacción de oxidación. Cuando usamos combustibles de hidrocarburos, los productos después de la combustión completa suelen ser dióxido de carbono y agua. En combustión completa, se forman pocos productos, y proporciona la máxima salida de energía que el reactivo puede dar. Sin embargo, para que se realice una combustión completa, el suministro de oxígeno ilimitado y constante y la temperatura óptima son los requisitos. Por lo tanto, la combustión completa no siempre es una reacción favorable.
¿Qué es la combustión incompleta??
Cuando no hay suficiente oxígeno, se produce una combustión incompleta.

Figura 02: Destrucción y contaminación de la combustión incompleta
Si la combustión no hubiera sucedido por completo, el monóxido de carbono y otras partículas liberadas en la atmósfera y pueden causar mucha contaminación.
¿Cuál es la diferencia entre la combustión completa e incompleta??
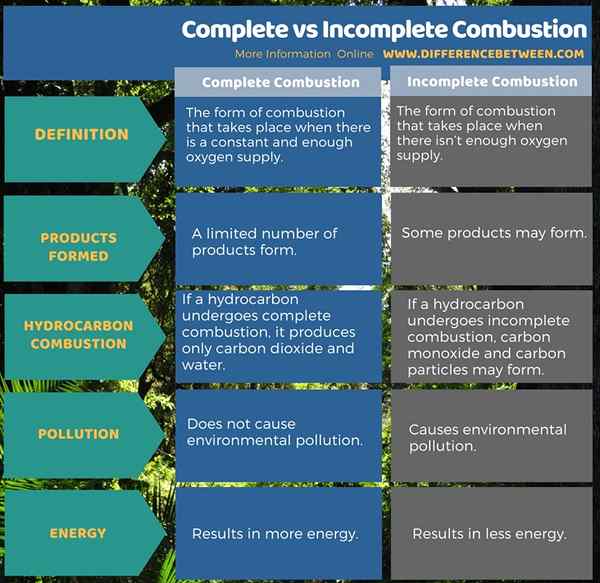
La combustión completa es en forma de combustión que tiene lugar cuando hay un suministro de oxígeno constante y suficiente. La combustión incompleta es la forma de combustión que tiene lugar cuando no hay suficiente suministro de oxígeno. En la combustión completa, se forman un número limitado de productos mientras está en combustión incompleta, algunos productos pueden formarse.
Además, si un hidrocarburo sufre una combustión completa, produce solo dióxido de carbono y agua, mientras que el monóxido de carbono y las partículas de carbono pueden formarse en combustión incompleta. Con preocupación por la energía producida por estas dos formas de combustión, la combustión completa da como resultado más energía, por el contrario, la combustión incompleta da como resultado menos energía. Además, la combustión completa no causa contaminación ambiental. Sin embargo, la combustión incompleta causa contaminación ambiental.
Resumen -Completa vs combustión incompleta
La combustión puede tener lugar en dos tipos como combustión completa e incompleta. Ambas son reacciones de oxidación. La diferencia entre la combustión completa e incompleta es que se produce una combustión completa cuando hay un suministro de oxígeno constante y suficiente, mientras que se produce una combustión incompleta cuando no hay suficiente suministro de oxígeno.
Referencia:
1. "GCSE Bitesize: combustión."BBC, BBC. Disponible aquí
2. "Combustión."Wikipedia, Fundación Wikimedia, 12 de mayo de 2018. Disponible aquí
Imagen de cortesía:
1.'486575859' por Paul Kretek (CC por 2.0) a través de Flickr
2.'Kuwait Burn Oilfield Crop1'by Jonas Jordan (dominio público) a través de Commons Wikimedia


