Diferencia entre el ácido conjugado y la base conjugada
El diferencia clave entre el ácido conjugado y la base conjugada es que Los ácidos conjugados donan protones, mientras que las bases conjugadas aceptan protones.
En 1923, dos científicos, Bronsted y Lowry presentaron una teoría sobre el comportamiento ácido-base. Según la teoría de Bronsted - Lowry, un ácido es un donante de protones, y una base es un aceptador de protones. Por lo tanto, una molécula para comportarse como un ácido debe encontrarse con un aceptador de protones. Por otro lado, una molécula para comportarse como base debe encontrarse con un donante de protones. Por lo tanto, para una reacción ácida-base, tanto los donantes de protones como los aceptores deben estar allí. Sin embargo, el agua puede actuar como ácido y base. Cuando el agua acepta un protón, forma un ion hidronio, y cuando dona un protón, produce un ion hidróxido.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es el ácido conjugado?
3. ¿Qué es la base conjugada?
4. Comparación de lado a lado: ácido conjugado vs base conjugada en forma tabular
5. Resumen
¿Qué es el ácido conjugado??
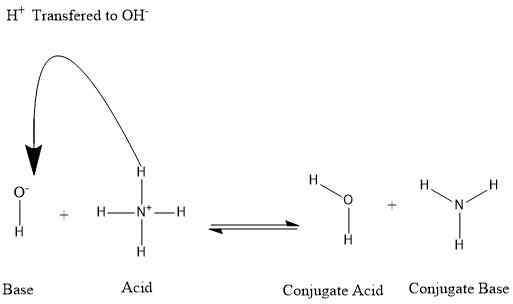
El ácido conjugado es una sustancia hecha de una base. Cuando una base acepta un protón de otra molécula, forma un ácido conjugado. El ácido conjugado puede eliminar el electrón y regresar a la base principal. Por lo tanto, los ácidos conjugados tienen propiedades ácidas.

Figura 01: Formación de ácido conjugado y base conjugada
Por ejemplo, podemos considerar la situación en la que el amoniaco se disuelve en el agua.
NUEVA HAMPSHIRE3+ H2O ⇌ NH4+ + OH-
En el ejemplo anterior, el ion amonio es el ácido conjugado del amoníaco. Del mismo modo, al considerar la reacción hacia atrás, el agua es el ácido conjugado de la base de hidróxido.
¿Qué es la base conjugada??
La base conjugada es una sustancia que se forma después de un ácido cede un protón a una base. Pero, esto puede aceptar un protón nuevamente; Por lo tanto, tiene características básicas. El posible aceptador de protones formado por el ácido padre es la base conjugada. Cuando la base conjugada acepta un protón, se revuelve al ácido padre nuevamente.
Además, muchos solventes pueden actuar como donantes o aceptores de protones. Por lo tanto, pueden inducir el comportamiento ácido o básico en solutos. Por ejemplo, cuando el amoníaco se disuelve en el agua, el agua actúa como ácido y da un protón al amoníaco y, por lo tanto, forman un ion amonio. Mientras tanto, la molécula de agua se convierte en un anión hidróxido. Aquí, la base conjugada del agua es el anión hidróxido. Y la base conjugada del amonio es el amoníaco.
¿Cuál es la diferencia entre el ácido conjugado y la base conjugada??
La diferencia clave entre el ácido conjugado y la base conjugada es que los ácidos conjugados pueden donar protones, mientras que las bases conjugadas pueden aceptar protones. Además, los ácidos conjugados se forman a partir de bases; Por el contrario, las bases conjugadas se forman a partir de ácidos. Sin embargo, los ácidos conjugados y las bases que se forman en una reacción espontánea son mucho más débiles que sus moléculas principales.

Resumen -base de ácido conjugado vs conjugado
El ácido conjugado y la base conjugada son un par de especies químicas que tiene un comportamiento químico opuesto. La diferencia clave entre el ácido conjugado y la base conjugada es que los ácidos conjugados pueden donar protones, mientras que las bases conjugadas pueden aceptar protones.
Referencia:
1. Bibliotecas. "11.12: pares de base ácida conjugada."Bibliotecas de química, National Science Foundation, 26 de noviembre. 2018. Disponible aquí
Imagen de cortesía:
1."Reacción base conjugada" por Schlenk (CC BY-SA 3.0) a través de Commons Wikimedia


