Diferencia entre la conjugación y la resonancia

Conjugación vs resonancia
La conjugación y la resonancia son dos fenómenos importantes para comprender el comportamiento de las moléculas.
Que es la conjugación?
En una molécula cuando hay enlaces individuales y múltiples alternos presentes, decimos que el sistema está conjugado. Por ejemplo, la molécula de benceno es un sistema conjugado. En un enlace múltiple, hay un enlace Sigma y uno o dos estanques PI. Los enlaces PI están formados por los orbitales P superpuestos. Los electrones en los orbitales P se encuentran perpendiculares al plano de la molécula. Entonces, cuando hay enlaces PI en enlaces alternos, todos los electrones se delocalizan en todo el sistema conjugado. En otras palabras, lo llamamos una nube de electrones. Dado que los electrones se deslocalizan, pertenecen a todos los átomos en el sistema conjugado, pero no solo por un átomo. Esto reduce la energía general del sistema y aumenta la estabilidad. No solo, los enlaces PI, sino también los pares de electrones solitarios, los radicales o los iones de carbenio pueden participar en la creación de un sistema conjugado. En estos casos, hay orbitales P no unidos con dos electrones, un electrón o ningún electrones presentes. Hay sistemas conjugados lineales y cíclicos. Algunos están restringidos a una sola molécula. Cuando hay estructuras de polímeros más grandes, puede haber sistemas conjugados muy grandes. La presencia de conjugación permite que las moléculas actúen como cromóforos. Los cromóforos pueden absorber la luz; Por lo tanto, el compuesto será colorido.
¿Qué es la resonancia??
Al escribir estructuras de Lewis, solo mostramos electrones de valencia. Al hacer que los átomos compartan o transfieran electrones, tratamos de dar a cada átomo la configuración electrónica de gas noble. Sin embargo, en este intento, podemos imponer una ubicación artificial en los electrones. Como resultado, se pueden escribir más de una estructura de Lewis equivalente para muchas moléculas e iones. Las estructuras escritas al cambiar la posición de los electrones se conocen como estructuras de resonancia. Estas son estructuras que solo existen en teoría. Las estructuras de resonancia indican dos hechos sobre la estructura.
• Ninguna de las estructuras de resonancia será la representación correcta de la molécula real. Y ninguno se parecerá por completo a las propiedades químicas y físicas de la molécula real.
• La molécula real o el ion estarán mejor representados por un híbrido de todas las estructuras de resonancia.
Las estructuras de resonancia se muestran con la flecha ↔. Las siguientes son las estructuras de resonancia del ion de carbonato (CO32-).
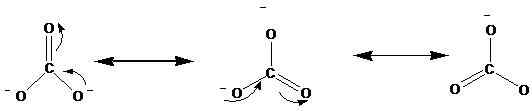
Los estudios de rayos X han demostrado que la molécula real está entre estas resonancias. Según los estudios, todos los enlaces de oxígeno de carbono están en igual longitud en el ion de carbonato. Sin embargo, según las estructuras anteriores, podemos ver un doble enlace y dos enlaces individuales. Por lo tanto, si estas estructuras de resonancia ocurren por separado, idealmente debe haber diferentes longitudes de enlace en el ion. Las mismas longitudes de enlace indican que ninguna de estas estructuras realmente se presenta en la naturaleza, más bien un híbrido de esto, existe.
| Cuál es la diferencia entre Conjugación y resonancia? • La resonancia y la conjugación están interrelacionadas. Si hay conjugación en una molécula, podemos dibujar estructuras de resonancia alternando los enlaces PI. Dado que los electrones PI se delocalizan en todo el sistema conjugado, todas las estructuras de resonancia son válidas para dicha molécula. • La resonancia permite que un sistema conjugado delocalice electrones. |


