Diferencia entre el espectro continuo y el espectro de línea
El diferencia clave entre el espectro continuo y el espectro de línea es que el El espectro continuo contiene todas las longitudes de onda en un rango dado, mientras que el espectro de línea contiene solo unas pocas longitudes de onda.
Hay principalmente dos tipos de espectros como espectro continuo y espectro de línea. El espectro de línea puede crear un espectro de absorción o un espectro de emisión. Los espectros de absorción y emisión de una especie ayudan a identificar esas especies y proporcionar mucha información sobre ellas.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es el espectro continuo?
3. ¿Qué es el espectro de línea?
4. Comparación lado a lado: espectro continuo vs espectro de línea en forma tabular
5. Resumen
¿Qué es el espectro continuo??
Cuando se juntan los espectros de absorción y emisión de una especie, forman un espectro continuo. Un espectro de absorción es una gráfica dibujada entre absorbancia y longitud de onda. A veces, en lugar de la longitud de onda, también podemos usar frecuencia o número de onda en el eje x. El valor de absorción de registro o el valor de transmisión también es útil para el eje y en algunas ocasiones. El espectro de absorción es característico para una molécula dada o un átomo. Por lo tanto, podemos usarlo para identificar o confirmar la identidad de una especie en particular.

Figura 01: Espectros continuos
Por lo tanto, si todas las longitudes de onda están presentes dentro de un límite dado, ese es un espectro continuo. Por ejemplo, el arco iris tiene los siete colores, y es un espectro continuo. El espectro continuo se forma cuando los objetos calientes como las estrellas, las lunas emiten radiaciones electromagnéticas en todas las longitudes de onda.
¿Qué es el espectro de línea??
Como dice el nombre, Line Spectrum tiene solo unas pocas líneas. En otras palabras, tienen pocas longitudes de onda. Por ejemplo, un compuesto de color es visible para nuestros ojos en ese color particular porque absorbe la luz del rango visible. En realidad, absorbe el color complementario del color que vemos. Por ejemplo, vemos un objeto como verde porque absorbe la luz púrpura del rango visible. Por lo tanto, el púrpura es el color complementario del verde.

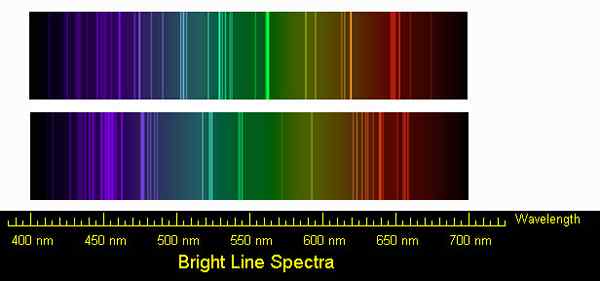
Figura 02: Espectros de línea para emisiones de sodio y calcio
Del mismo modo, los átomos o moléculas también absorben ciertas longitudes de onda de la radiación electromagnética (estas longitudes de onda no necesariamente están en el rango visible). Cuando un haz de radiación electromagnética pasa a través de una muestra que contiene átomos gaseosos, los átomos absorben solo algunas longitudes de onda. Por lo tanto, cuando registramos el espectro, consiste en una serie de líneas de absorción muy estrechas. Y este es un espectro de línea de absorción. Es característico de un tipo de átomo. Los átomos usan energía absorbida para excitar electrones molidos a los niveles superiores en el átomo. Dado que la diferencia de energía es discreta y constante, el mismo tipo de átomos siempre absorberá las mismas longitudes de onda de la radiación dada. Cuando este electrón excitado regresa al nivel del suelo, emite la radiación absorbida y formará un espectro de la línea de emisión.
¿Cuál es la diferencia entre el espectro continuo y el espectro de línea??
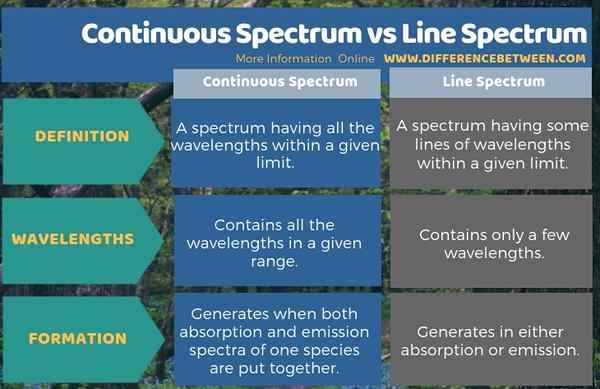
El espectro continuo es un espectro que tiene todas las longitudes de onda dentro de un límite dado, mientras que el espectro de línea es un espectro que tiene algunas líneas de longitudes de onda dentro de un límite dado. Por lo tanto, el espectro continuo y el espectro de línea difieren entre sí de acuerdo con la presencia o ausencia de líneas en el espectro. Por lo tanto, podemos considerar esto como la diferencia clave entre el espectro continuo y el espectro de línea. Estas líneas ocurren en el espectro de línea porque contiene solo unas pocas longitudes de onda, mientras que el espectro continuo contiene todas las longitudes de onda en un rango dado.
Al considerar la formación de cada espectro, podemos encontrar otra diferencia significativa entre el espectro continuo y el espectro de línea. Es decir, en la formación de un espectro continuo, los espectros de absorción y emisión de una especie se juntan, mientras que el espectro de absorción o emisión genera el espectro de línea.
Resumen -Espectro continuo vs Line Spectrum
El espectro continuo y el espectro de línea son dos tipos de espectros de absorción y emisión. La diferencia clave entre el espectro continuo y el espectro de línea es que el espectro continuo contiene todas las longitudes de onda en un rango dado, mientras que el espectro de línea contiene solo unas pocas longitudes de onda.
Referencia:
1. Bibliotecas. "6.3: Spectra de línea y el modelo BOHR."Bibliotecas de química, Librettexts, 25 de julio de 2018. Disponible aquí
Imagen de cortesía:
1."Spectrum -Srgb" por Phrood - trabajo propio, (dominio público) a través de Commons Wikimedia
2."Espectros de sodio y calcio" de la NASA (dominio público) a través de Commons Wikimedia


