Diferencia entre la reacción acoplada y desacoplada
El diferencia clave Entre la reacción acoplada y no acoplada es que Las reacciones acopladas muestran la transferencia de energía de un lado de la reacción al otro lado, mientras que las reacciones desacopladas no implican una transferencia de energía.
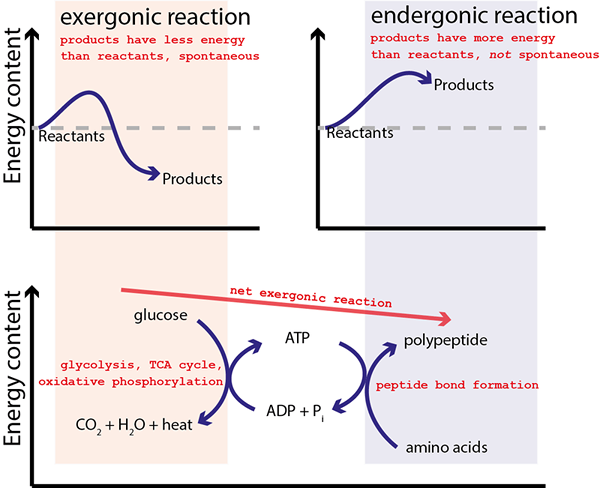
La mayoría de las reacciones químicas que sabemos son endergónicas, lo que significa que las reacciones no son espontáneas. Por lo tanto, la energía libre de Gibbs de estas reacciones es mayor que cero. Estas reacciones requieren energía del entorno externo para ocurrir la reacción. Por lo tanto, podemos acoplar estas reacciones con una reacción exergónica separada que "impulsa" la reacción no espontánea. Estas dos reacciones acopladas a menudo comparten estados intermedios.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es una reacción acoplada?
3. ¿Qué es una reacción desacoplada?
4. Comparación de lado a lado: reacción acoplada vs desacoplada en forma tabular
5. Resumen
¿Qué es una reacción acoplada??
Las reacciones acopladas son reacciones químicas que tienen un estado intermedio para el proceso de transferencia de energía. En otras palabras, estas reacciones se forman a partir de la combinación de dos reacciones diferentes donde hay un estado intermedio común en el que la energía se transfiere de un lado de la reacción al otro lado.
La mayoría de las reacciones químicas que sabemos son endergónicas (no espontáneas). Por lo tanto, estas reacciones requieren un suministro de energía para la reacción. Para este propósito, las reacciones no espontáneas se pueden acoplar con otra reacción química que puede suministrar energía para "impulsar" la reacción no espontánea. La reacción química inicial fue termodinámicamente desfavorable, y después del proceso de acoplamiento, se vuelve termodinámicamente favorable. Las dos reacciones se unen a través de un estado intermedio que es común a ambas reacciones. Luego, la energía Gibbs para cada media reacción se puede sumar para producir la energía libre de Gibbs combinada para la reacción acoplada.

Figura 01: reacciones acopladas
Un ejemplo común de una reacción acoplada es la formación de ATP, que es un proceso endergónico, y está acoplado a la disipación de un gradiente de protones.
¿Qué es una reacción desacoplada??
Las reacciones no acopladas son reacciones químicas que no tienen estado intermedio para la transferencia de energía. Un ejemplo para una reacción sin acoplar es la reacción combinada de glucosa y fructosa para formar sacarosa. Esta reacción es termodinámicamente desfavorable porque requiere alta energía.
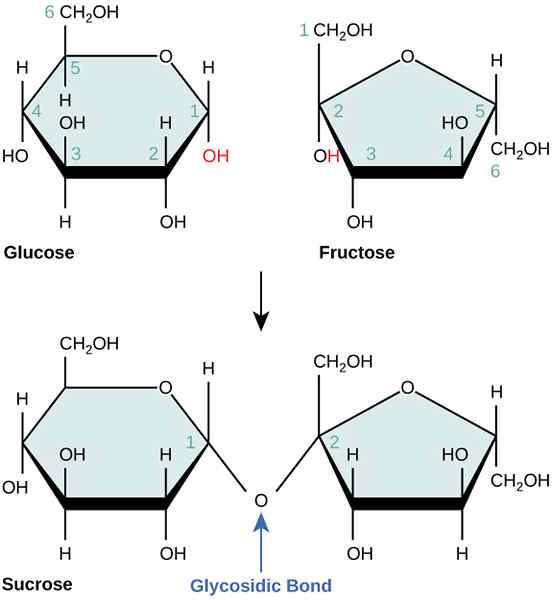
Figura 02: Combinación de glucosa y fructosa para formar sacarosa
Sin embargo, si combinamos esta reacción con la reacción de hidrólisis de ATP, entonces la reacción es posible y tiene lugar en dos pasos energéticamente favorables, compartiendo un estado intermedio común. Entonces se convierte en una reacción acoplada.
¿Cuál es la diferencia entre la reacción acoplada y desacoplada??
La mayoría de las reacciones químicas que sabemos no son espontáneas; Por lo tanto, necesitamos acoplarlos con algunas otras reacciones para hacer que progresen. Por lo tanto, este nuevo tipo de reacción se denomina reacción acoplada, mientras que el tipo de reacción no espontáneo anterior se llama reacción desacoplada. La diferencia clave entre la reacción acoplada y no acoplada es que las reacciones acopladas muestran energía que se transfiere de un lado de la reacción al otro lado, mientras que en las reacciones no acopladas no se realizan transferencia de energía.
Abajo la infografía tabula más diferencias entre la reacción acoplada y no acoplada.
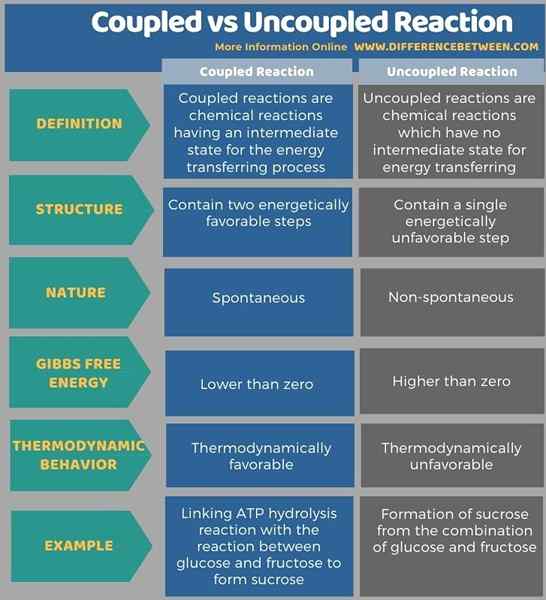
Resumen: reacción acoplada vs desacoplada
La mayoría de las reacciones químicas que sabemos no son espontáneas; Por lo tanto, necesitamos acoplarlos con algunas otras reacciones para hacer que progresen. Este nuevo tipo de reacción se llama reacción acoplada, mientras que el tipo de reacción no espontáneo anterior se llama reacción desacoplada. La diferencia clave entre la reacción acoplada y no acoplada es que las reacciones acopladas muestran energía que se transfiere de un lado de la reacción al otro lado, mientras que en las reacciones no acopladas no se realizan transferencia de energía.
Referencia:
1. "7.7: Reacciones acopladas."Bibliotecas de química, Librettexts, 11 de agosto. 2020, disponible aquí.
Imagen de cortesía:
1. "Reacciones acopladas" de Muessig - Trabajo propio (CC BY -SA 3.0) a través de Commons Wikimedia
2. "Figura 03 02 04" por CNX OpenStax - (CC por 4.0) a través de Commons Wikimedia


