Diferencia entre covalencia y estado de oxidación
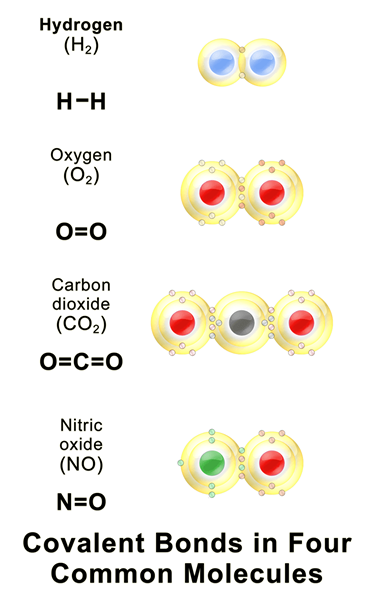
Diferencia clave: covalencia VS Estado de oxidación
Los átomos de diferentes elementos químicos están unidos entre sí formando diferentes compuestos químicos. En la formación de un compuesto, los átomos se unen entre sí a través de enlaces iónicos o enlaces covalentes. La covalencia y el estado de oxidación son dos términos que describen el estado de estos átomos en los compuestos químicos. La covalencia es el número de enlaces covalentes que un átomo puede formar. Por lo tanto, la covalencia depende de la cantidad de electrones que el átomo puede compartir con otros átomos. El estado de oxidación de un átomo es el número de electrones obtenidos o perdidos por un átomo particular al formar un enlace químico. El diferencia clave entre la covalencia y el estado de oxidación es que el La covalencia de un átomo es el número de enlaces covalentes que el átomo puede formarse, mientras que el estado de oxidación de un átomo es el número de electrones perdidos o ganados por un átomo al formar un enlace químico.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es la covalencia?
3. ¿Qué es el estado de oxidación?
4. Comparación de lado a lado: covalencia frente al estado de oxidación en forma tabular
5. Resumen
¿Qué es la covalencia??
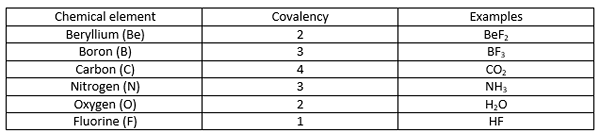
La covalencia es el número de enlaces covalentes que un átomo puede formar con otros átomos. Por lo tanto, la covalencia está determinada por el número de electrones presentes en el orbital más externo de un átomo. Sin embargo, los términos valencia y covalencia no deben confundirse porque tienen diferentes significados. La valencia es el poder de combinación de un átomo. A veces, la covalencia es igual a la valencia. Sin embargo, no sucede siempre.
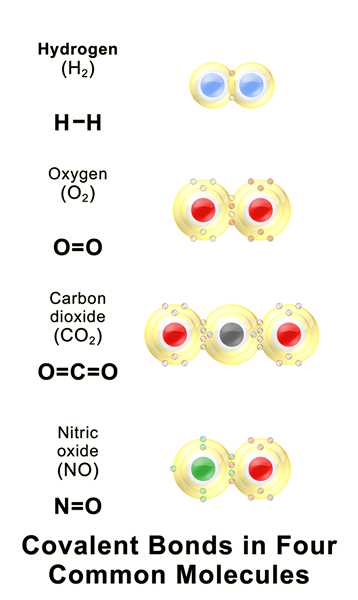
Figura 01: algunos compuestos covalentes comunes
Un enlace covalente es un enlace químico que se forma cuando dos átomos comparten sus electrones no emparejados más externos para completar la configuración de electrones. Cuando un átomo tiene carcasas u orbitales de electrones incompletos, ese átomo se vuelve más reactivo porque las configuraciones de electrones incompletas son inestables. Por lo tanto, estos átomos ganan/electrones sueltos o comparten electrones para llenar las cubiertas de electrones. La siguiente tabla muestra algunos ejemplos de elementos químicos con diferentes valores de covalencia.
¿Qué es el estado de oxidación??
El estado de oxidación de un átomo es el número de electrones perdidos, obtenidos o compartidos por ese átomo con otro átomo. Si los electrones se pierden o se obtienen, la carga eléctrica de un átomo se cambia en consecuencia. Los electrones son partículas subatómicas cargadas negativamente cuya carga está neutralizada por la carga positiva de los protones en ese átomo. Cuando se pierden electrones, el átomo obtiene una carga positiva, mientras que cuando se obtienen electrones, el átomo obtiene una carga negativa neta. Esto sucede debido al desequilibrio de las cargas positivas de los protones en el núcleo. Esta carga se puede dar como el estado de oxidación de ese átomo.
El estado de oxidación de un átomo se denota por un número completo con el signo positivo (+) o negativo (-). Este signo indica si el átomo ha ganado o perdido electrones. El número entero da la cantidad de electrones que se han intercambiado entre átomos.
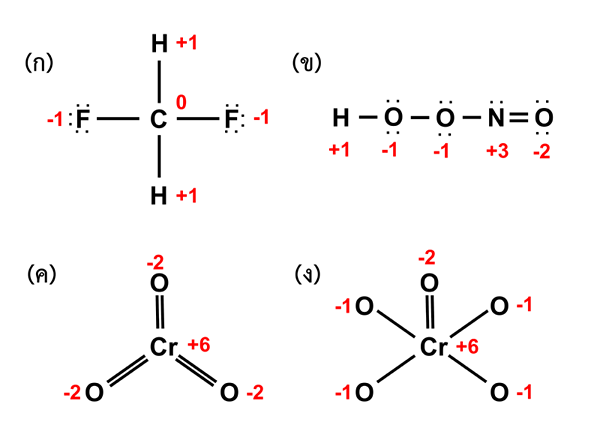
Figura 02: Estado de oxidación de diferentes compuestos
Determinación del estado de oxidación de un átomo
El estado de oxidación de un átomo en particular se puede determinar utilizando las siguientes reglas.
- El estado de oxidación de un elemento neutro siempre es cero. Ej: El estado de oxidación de sodio (NA) es cero.
- La carga total del compuesto debe igual a la suma de las cargas de cada átomo presente en ese compuesto. Ej: la carga total de KCL es cero. Entonces los cargos de K y CL deben ser +1 y -1.
- El estado de oxidación del elemento del grupo 1 es siempre +1. Los elementos del Grupo 1 son litio, sodio, potasio, rubidio, cesio y Francium.
- El estado de oxidación de los elementos del grupo 2 es siempre +2. Los elementos del Grupo 2 son berilio, magnesio, calcio, estroncio, bario y radio.
- La carga negativa se da al átomo que tiene una electronegatividad más alta que la de los otros átomos unidos a él.
- El estado de oxidación del hidrógeno siempre es +1, excepto cuando el hidrógeno se une a un metal del Grupo 1.
- El estado de oxidación del oxígeno es -2 excepto cuando está en forma de peróxido o superóxido.
¿Cuál es la diferencia entre covalencia y estado de oxidación??
Covalencia versus estado de oxidación | |
| La covalencia es el número de enlaces covalentes que un átomo puede formar con otros átomos. | El estado de oxidación de un átomo es el número de electrones perdidos, obtenidos o compartidos por ese átomo con otro átomo. |
| Carga eléctrica | |
| La covalencia no indica la carga eléctrica de un átomo. | El estado de oxidación da la carga eléctrica de un átomo. |
| Enlace químico | |
| La covalencia indica el número de enlaces químicos (enlaces covalentes) que puede tener un átomo particular. | El estado de oxidación no da detalles sobre los enlaces químicos formados por un átomo. |
| Estado del elemento | |
| La covalencia de un elemento puro depende del número de electrones presentes en la cubierta de electrones más externa de un átomo de ese elemento. | El estado de oxidación de un elemento puro es siempre cero. |
Resumen - Covalencia VS Estado de oxidación
El estado de covalencia y oxidación de los átomos describe la naturaleza química de un átomo en un compuesto químico. La diferencia entre la covalencia y el estado de oxidación es que la covalencia de un átomo es el número de enlaces covalentes que el átomo puede formarse, mientras que el estado de oxidación de un átomo es el número de electrones perdidos o ganados por un átomo al formar un enlace químico.
Referencia:
1."Covalencia."Com, diccionario.comunicarse. Disponible aquí
2."Estado de oxidación."Wikipedia, Fundación Wikimedia, 5 Mar. 2018. Disponible aquí
3.“Covalencia química y estructuras moleculares."Com. Disponible aquí
Imagen de cortesía:
1.'Bonos covalentes' por Bruceblaus - Trabajo propio, (CC By -SA 4.0) a través de Commons Wikimedia
2.'Asignaciones de estado de oxidación' por Saranphong Yimklan - Trabajo propio, (dominio público) a través de Commons Wikimedia


