Diferencia entre enlaces covalentes y no covalentes
El diferencia clave entre los enlaces covalentes y no covalentes es que Los enlaces covalentes se forman cuando dos átomos comparten sus electrones entre sí, mientras que los enlaces no covalentes se forman al intercambiar completamente los electrones entre dos átomos o al no intercambiar ningún electrón.
Hay cuatro tipos principales de enlaces químicos: enlaces covalentes, enlaces iónicos, enlaces de hidrógeno e interacciones de van der Waals. Cuando clasificamos los enlaces químicos como enlaces covalentes y no covalentes, las interacciones iónicas, de hidrógeno y van der Waals se dividen en la categoría de enlaces no covalentes.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué son los enlaces covalentes?
3. ¿Qué son los enlaces no covalentes?
4. Comparación de lado a lado: enlaces covalentes vs no covalentes en forma tabular
5. Resumen
¿Qué son los enlaces covalentes??
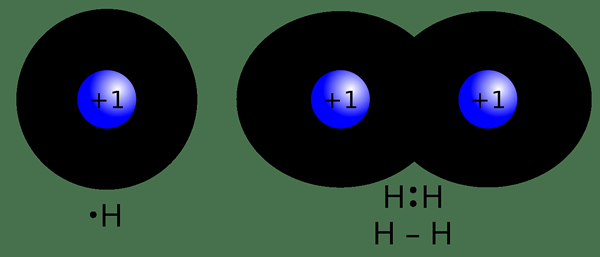
Un enlace covalente es un tipo de enlace químico que se forma cuando dos átomos comparten un par de electrones entre ellos. Se nombra como un "enlace molecular". Estos enlaces se forman cuando existen "pares compartidos" o "pares de unión" entre átomos. Se forma un enlace covalente debido al equilibrio estable de fuerzas atractivas y repulsivas entre los átomos cuando comparten electrones. Compartir electrones entre átomos permite que cada átomo tenga el equivalente de una carcasa externa completa. Por lo general, este tipo de enlace se forma entre dos átomos no metálicos que tienen valores de electronegatividad casi similares o entre un electrón y un ion metálico cargado positivamente.

Hay dos tipos principales de enlaces covalentes: enlaces covalentes polares y enlaces covalentes no polares. Existen enlaces covalentes polar entre dos átomos con una diferencia entre sus valores de electronegatividad en el rango de 0.4 a 1.7. Se forman enlaces covalentes no polares si esta diferencia es inferior a 0.4. Aquí, una alta diferencia entre los valores de electronegatividad significa, un átomo (que tiene el mayor valor de electronegatividad) atrae a los electrones más que al otro átomo, lo que hace que el enlace sea polar.
Según el número de pares de electrones que se comparten entre dos átomos, podemos identificar tres tipos principales de enlaces covalentes como enlaces individuales, que involucran un par de electrones, enlaces dobles, que involucran dos pares de electrones y un triple enlace, que implica Tres pares de electrones.
¿Qué son los enlaces no covalentes??
Los enlaces no covalentes son enlaces químicos que se forman al intercambiar completamente los electrones entre los átomos o al no intercambiar electrones en absoluto. Hay tres tipos de enlaces no covalentes como enlaces iónicos, enlaces de hidrógeno e interacciones de van der Waals.
Un átomo puede ganar o perder electrones y formar partículas cargadas negativas o positivas para obtener una configuración de electrones estable. Llamamos a estas partículas "iones". Tienen interacciones electrostáticas entre ellos. Un vínculo iónico puede describirse como la fuerza de atracción entre estos iones cargados opuestos. La interacción electrostática entre iones está influenciada por la electronegatividad de los átomos en el enlace iónico. Por lo tanto, la electronegatividad da una medición de la afinidad de los átomos por los electrones. Un átomo con alta electronegatividad puede atraer electrones de un átomo con baja electronegatividad para formar un enlace iónico.

Los enlaces de hidrógeno son otro enlace no covalente. Es un tipo de fuerza de atracción entre dos átomos de dos moléculas diferentes, que es una fuerza de atracción débil. Sin embargo, al compararse con otros tipos de fuerzas intramoleculares, como las interacciones polar-polares, las interacciones no polar-nopolar como las fuerzas de Vander Waal, los enlaces de hidrógeno son más fuertes. Por lo general, los enlaces de hidrógeno se forman entre las moléculas covalentes polares. Estas moléculas contienen enlaces covalentes polar, que se forman como resultado de la diferencia en los valores de electronegatividad de los átomos que están en el enlace covalente.
Las interacciones de van der Waals son otro tipo de enlace no covalente. Son fuerzas de atracción débiles entre dos átomos en dos moléculas no polares. Una interacción Van der Waals es una atracción o repulsión inducida que es causada por correlaciones en las polarizaciones fluctuantes de partículas cercanas.
¿Cuál es la diferencia entre enlaces covalentes y no covalentes??
Los enlaces covalentes y no covalentes son las dos clases amplias de enlaces químicos en química. Los enlaces covalentes se pueden encontrar en tres subgrupos más como enlaces iónicos, enlaces de hidrógeno e interacciones de van der Waals. La diferencia clave entre los enlaces covalentes y no covalentes es que los enlaces covalentes se forman cuando dos átomos comparten sus electrones entre sí, mientras que los enlaces no covalentes se forman al intercambiar completamente los electrones entre dos átomos o al no intercambiar ningún electrones.
A continuación, las infografías enumera las diferencias entre los enlaces covalentes y no covalentes con más detalle.

Resumen -enlaces covalentes vs no covalentes
Los enlaces covalentes y no covalentes son las dos clases amplias de enlaces químicos en química. Los enlaces covalentes se pueden encontrar en tres subgrupos más como enlaces iónicos, enlaces de hidrógeno e interacciones de van der Waals. La diferencia clave entre los enlaces covalentes y no covalentes es que los enlaces covalentes se forman cuando dos átomos comparten sus electrones entre sí, mientras que los enlaces no covalentes se forman al intercambiar completamente los electrones entre dos átomos o al no intercambiar ningún electrones.
Referencia:
1. "Las fuerzas de van der Waals."Bibliotecas de química, Librettexts, 15 de agosto. 2020, disponible aquí.
Imagen de cortesía:
1. "Hidrógeno de enlace covalente" de Jacek FH - Trabajo propio (CC BY -SA 3.0) a través de Commons Wikimedia
2. "Binción iónica" de Jayron32.hablar.Contribs: creé este trabajo completamente solo. (CC BY-SA 3.0) a través de Commons Wikimedia


