Diferencia entre el punto crítico y el punto triple
Diferencia clave: punto crítico vs Triple Punto
El punto crítico y el punto triple son términos utilizados para explicar las temperaturas y presiones a las que dos o más fases de las sustancias pueden coexistir entre sí. El punto crítico es la condición en la que coexisten la fase de líquido y vapor de la misma sustancia. El punto triple es la condición en la que las tres fases de la materia pueden coexistir entre sí. El diferencia clave entre un punto crítico y el triple punto es que El punto crítico describe la coexistencia de dos fases de la misma sustancia, mientras que el punto triple describe la coexistencia de tres fases de la misma sustancia.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es el punto crítico?
3. ¿Qué es triple punto?
4. Similitudes entre punto crítico y punto triple
5. Comparación de lado a lado: punto crítico vs punto triple en forma tabular
6. Resumen
¿Qué es el punto crítico??
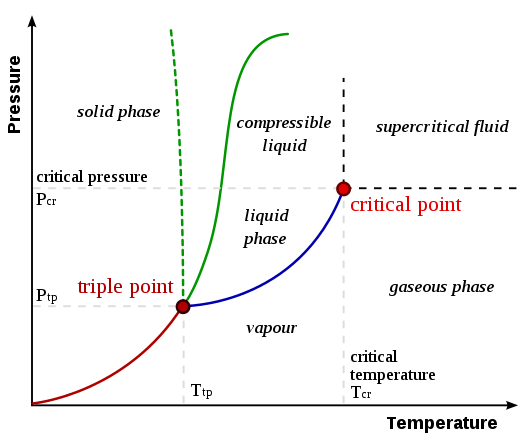
El punto crítico de una sustancia es el punto final de la curva de equilibrio de fase de esa sustancia. Una curva de equilibrio de fase o un diagrama de fase es la gráfica de presión versus la temperatura en la que se muestran los cambios de fase de la sustancia. Esto muestra las temperaturas y la presión a la que la sustancia existe como un sólido, líquido o gas. El punto crítico es la temperatura y la presión a la que coexisten la fase de líquido y vapor.

Figura 01: un diagrama de fase que muestra el punto crítico y el punto triple
La temperatura y la presión en el punto crítico se nombran como temperatura crítica (TC) y presión crítica (PC). Como se muestra en la imagen de arriba, las líneas entre dos fases se conocen como límites. Un punto crítico indica el punto en el que desaparecen los límites de línea.
Conocer el punto crítico de una sustancia a veces es muy importante. Por ejemplo, un gas nunca puede condensarse a temperaturas y presiones por encima de su punto crítico. Esto se debe a que las fuerzas intermoleculares entre la molécula de gas se debilitan a temperaturas muy altas ya que la energía cinética de esas moléculas aumenta.
Hay dos tipos del punto crítico;
-
Punto crítico de vapo líquido
Este es un punto crítico típico en el que el vapor de una sustancia coexiste con su forma líquida. El punto crítico del agua es de 647 k y 22.064 MPA.
-
Punto crítico líquido-líquido
Este tipo de puntos críticos se define para soluciones. Es la temperatura y la presión a la que una mezcla de solución se separa en dos fases líquidas distintas.
¿Qué es triple punto??
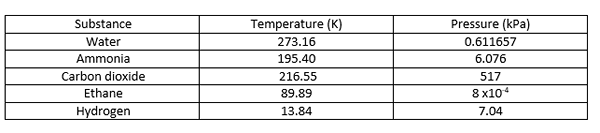
El punto triple es la temperatura y la presión a la que las fases sólidas, líquidas y de vapor de una sustancia particular coexisten en equilibrio. Describe un estado termodinámico específico de mate. A veces, el punto triple puede involucrar más de una fase sólida cuando existen polimorfos de la sustancia. En un diagrama de fase, el punto triple es el punto en el que las tres líneas límite se encuentran entre sí. Algunos ejemplos de puntos triples se dan a continuación.
¿Cuáles son las similitudes entre el punto crítico y el punto triple??
- Tanto el punto crítico como el punto triple describen ciertas temperaturas y presiones específicas.
- Tanto el punto crítico como el punto triple describen estados de equilibrio donde coexisten dos o más estados físicos de una sustancia.
¿Cuál es la diferencia entre el punto crítico y el punto triple??
Punto crítico vs punto triple | |
| El punto crítico de una sustancia es el punto final de la curva de equilibrio de fase de esa sustancia. | El punto triple es la temperatura y la presión a la que las fases sólidas, líquidas y de vapor de una sustancia particular coexisten en equilibrio. |
| Etapas | |
| El punto crítico describe la coexistencia de dos fases de la misma sustancia. | Triple Point describe la coexistencia de tres fases de la misma sustancia. |
| El agua como ejemplo | |
| El punto crítico del agua es de 647 k y 22.064 MPA. | El triple punto de agua está en 273.16 K y 0.611657 MPA. |
| Diagrama de fases | |
| El punto crítico es el punto final de una curva de diagrama de fase. | El punto triple es el punto en el que toda la línea de límite se reúne entre sí. |
Resumen - Punto crítico vs Triple Punto
El punto crítico de una sustancia es el punto final de la curva de equilibrio de fase de esa sustancia que da la temperatura y la presión a la que la fase de líquido y vapor de una sustancia puede coexistir entre sí. El punto triple da la temperatura y la presión a la que las tres fases de la materia pueden coexistir entre sí. La diferencia entre un punto crítico y el punto triple es que el punto crítico describe la coexistencia de dos fases de la misma sustancia, mientras que el punto triple describe la coexistencia de tres fases de la misma sustancia.
Referencia:
1.Helmenstine, Anne Marie, D. "Definición y ejemplo de triple punto (química)."Thinkco, nov. 10, 2017. Disponible aquí
2."Triple punto."Wikipedia, Fundación Wikimedia, 6 mar. 2018. Disponible aquí
3."Punto crítico."Bibliotecas de química, Librettexts, 21 de julio de 2016. Disponible aquí
Imagen de cortesía:
1.'Phase-DiaG2' por Matthieumarechal, (CC BY-SA 3.0) a través de Commons Wikimedia