Diferencia entre sólidos cristalinos y no cristalinos
El diferencia clave entre sólidos cristalinos y no cristalinos es que Los sólidos cristalinos tienen una disposición tridimensional distribuida de átomos, iones o moléculas, mientras que los sólidos no cristalinos no tienen una disposición consistente de partículas.
Los sólidos cristalinos y los sólidos no cristalinos son las dos categorías principales de sólidos que muestran alguna diferencia entre ellos en términos de la disposición de las partículas constituyentes y otras propiedades. Tienen diferencias en sus geometrías y otras propiedades físicas también.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué son los sólidos cristalinos?
3. ¿Qué son los sólidos no cristalinos?
4. Comparación lado a lado: sólidos cristalinos versus no cristalinos en forma tabular
5. Resumen
¿Qué son los sólidos cristalinos??
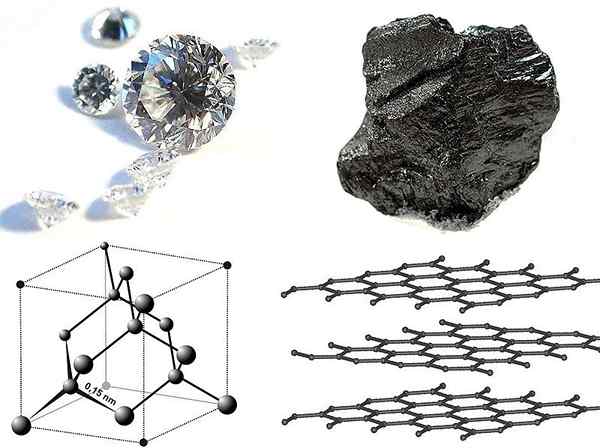
En sólidos cristalinos, las partículas constituyentes (átomos, moléculas o iones) se arreglan de manera periódica tridimensional. Se unen entre sí a través de planos o caras. La unidad de repetición más pequeña en estos sólidos es la "celda unitaria". Todas las células unitarias en un sólido en particular son idénticos y se repiten. Por ejemplo; Las celdas unitarias son como ladrillos en una pared.

Diamante y grafito: ejemplos de sólidos cristalinos
Los sólidos cristalinos también se pueden clasificar de la siguiente manera.
| Tipo | Componentes | Fuerzas intermoleculares | Propiedades |
| Sólidos iónicos (Sal de mesa - NaCl) | Iones positivos y negativos | Atracciones electrostáticas | Puntos de fusión muy altos, conductores pobres, frágil |
| Sólidos moleculares (Sacarosa) | Átomos y moléculas | Fuerzas de dispersión de Londres y atracciones dipolo-dipolo, enlaces de hidrógeno | Bajo punto de fusión, conductores flexibles y pobres |
| Red covalente (Grafito, diamante) | Átomos | Bonos covalentes, Fuerzas débiles de Londres | Muy altos puntos de fusión y ebullición, conductores pobres |
| Sólidos metálicos | Átomos de metal | Enlaces metálicos | Alto punto de fusión, suaves, muy duros, buenos conductores |
¿Qué son los sólidos no cristalinos??
Los sólidos no cristalinos son "sólidos amorfos". A diferencia de los sólidos cristalinos, no tienen una forma geométrica definida. Los átomos en sólidos se unen de cerca que en líquidos y gases. Sin embargo, en los sólidos no cristalinos, las partículas tienen un poco de libertad de moverse, ya que no están dispuestas rígidamente como en otros sólidos. Estos sólidos se forman después del enfriamiento repentino de un líquido. Los ejemplos más comunes son el plástico y el vidrio.

¿Cuál es la diferencia entre sólidos cristalinos y no cristalinos??
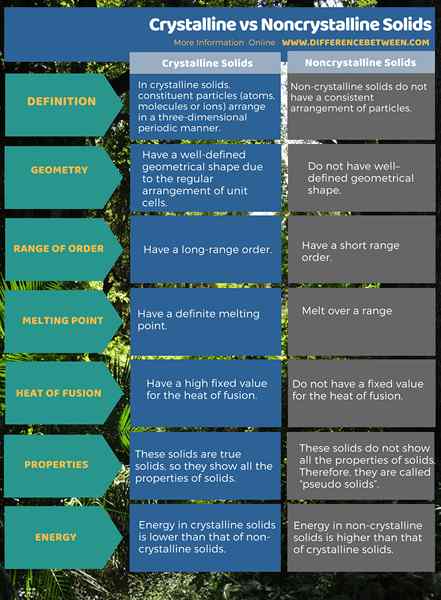
En sólidos cristalinos, las partículas constituyentes (átomos, moléculas o iones) se arreglan de manera periódica tridimensional. Los sólidos no cristalinos no tienen una disposición consistente de partículas. Entonces, los sólidos no cristalinos son sólidos amorfos. Con respecto a la geometría de estos sólidos, los sólidos cristalinos tienen una forma geométrica bien definida debido a la disposición regular de las células unitarias, a diferencia de los sólidos no cristalinos que no tienen bien-forma geométrica definida. Además, los sólidos cristalinos tienen un orden de largo alcance, mientras que los sólidos no cristalinos tienen un orden de corto alcance.
Los sólidos cristalinos tienen un alto valor fijo para el calor de la fusión y un punto de fusión definitivo. Sin embargo, los sólidos no cristalinos no tienen un valor fijo para el calor de la fusión y se derriten en un rango. Además, los sólidos cristalinos son sólidos verdaderos. Muestran todas las propiedades de los sólidos. Por el contrario, los sólidos no cristalinos no muestran todas las propiedades de los sólidos. Por lo tanto, se llaman "pseudo sólidos". La energía en los sólidos cristalinos es menor que la de los sólidos no cristalinos.
Resumen -Sólidos cristalinos vs no cristalinos
Las dos categorías principales de sólidos son sólidos cristalinos y sólidos no cristalinos. La diferencia entre los sólidos cristalinos y no cristalinos es que los sólidos cristalinos tienen una disposición tridimensional distribuida de átomos, iones o moléculas, mientras que los sólidos no cristalinos no tienen una disposición consistente de partículas.
Referencia:
1. "Solido cristalino.Reacción de Mannich | Mecanismo de reacción de Mannich | [Correo electrónico protegido] Disponible aquí
2. "Sólidos amorfos y cristalinos."Askiitians.comunicarse. Disponible aquí


