Diferencia entre el enlace dπ-dπ y el enlace delta
El diferencia clave entre el enlace dπ-dπ y el enlace delta es que El enlace Dπ-Dπ se forma entre un orbital atómico D relleno y un orbital atómico D vacío, mientras que el enlace delta se forma entre cuatro lóbulos de un orbital atómico y cuatro lóbulos de otro involucrado orbital atómico involucrado.
Tanto el enlace dπ-dπ como la forma del enlace delta a través de la superposición de los orbitales atómicos. La superposición de los orbitales en la formación de enlaces dπ-dπ crea un enlace de coordenada mientras la superposición en la formación de enlaces delta forma un enlace químico covalente.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es el enlace dπ-dπ?
3. ¿Qué es Delta Bond?
4. Comparación de lado a lado - enlace dπ -dπ vs enlace delta en forma tabular
5. Resumen
¿Qué es el enlace dπ-dπ??
Un enlace dπ-dπ es un tipo de enlace químico covalente donde un metal se une con un ligando a través de la superposición de sus orbitales D. En otras palabras, este tipo de enlaces químicos covalentes se forma cuando el orbital D lleno del metal de transición dona algunos de sus electrones a los orbitales d vacíos de un ligando para formar enlaces químicos de coordinación. Por lo tanto, estos compuestos químicos se nombran como complejos de coordinación.
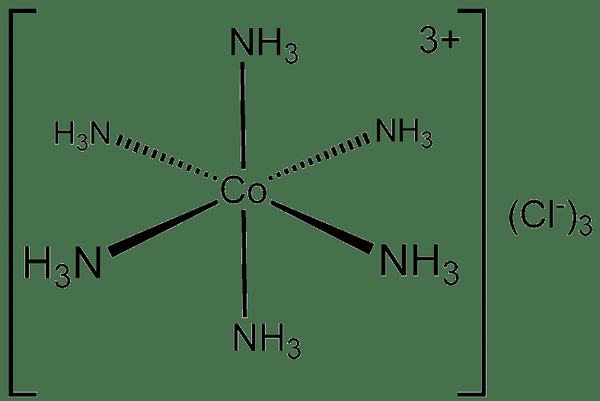
Figura 01: un compuesto covalente coordinado
A diferencia de los enlaces delta, que se asemejan a la estructura de un enlace dπ-dπ, el enlace dπ-dπ ocurre entre un orbital D relleno y un orbital D vacío. Además, puede ocurrir un enlace delta entre dos átomos que habían involucrado orbitales atómicos, mientras que se produce un enlace dπ-dπ entre un metal de transición que ha completado la configuración de electrones D y un ligando que tiene orbitales vacíos en la carcasa de electrones D.
¿Qué es un bono delta??
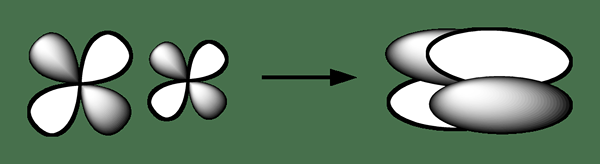
El enlace delta es un tipo de enlace químico donde cuatro lóbulos de un orbital atómico involucrado tienden a superponerse con cuatro lóbulos de otro orbital atómico involucrado para formar este enlace. Este tipo de superposición orbital conduce a la formación de un orbital molecular (unión) que consta de dos planos nodales que contienen el eje internuclear, y que pasa por ambos átomos. La carta griega para el signo de Delta "" se usa para la notación de un bono delta.

Figura 02: Formación de un enlace químico delta
En general, la simetría orbital del enlace delta es similar al tipo de orbital atómico habitual cuando se considera el eje de enlace. Podemos observar este tipo de unión química en átomos que habían ocupado D orbitales atómicos que contienen baja energía para participar en la unión química covalente. Por ejemplo, los metales de transición que se encuentran en especies químicas organometálicas muestran unión delta; Los compuestos químicos de algunos metales como el renio, el molibdeno y el cromo contienen enlaces cuádruples. Un vínculo cuádruple consiste en un enlace Sigma, dos enlaces PI y un enlace delta.
Al considerar la simetría orbital de un enlace delta, podemos observar que la simetría es diferente de la de un orbital Pi Antibonding. Un orbital de antibonding PI contiene un plano nodal que consiste en el eje internuclear y otro plano nodal que es perpendicular al eje entre átomos.
El científico Robert Mulliken introdujo la notación del Delta en 1931. Identificó este enlace primero usando el compuesto químico de potasio octaclorodirenato (iii).
¿Cuál es la diferencia entre el enlace dπ-dπ y el enlace delta??
El enlace Dπ-Dπ y el enlace delta son dos tipos de enlaces químicos covalentes. La diferencia clave entre el enlace dπ-dπ y el enlace delta es que el enlace dπ-dπ se forma entre un orbital atómico d relleno y un orbital atómico d vacío, mientras que el enlace delta se forma entre cuatro lóbulos de un orbital atómico y cuatro lóbulos de otro involucrado.
Antes de que la infografía resume las diferencias entre el enlace dπ-dπ y el enlace delta en forma tabular.
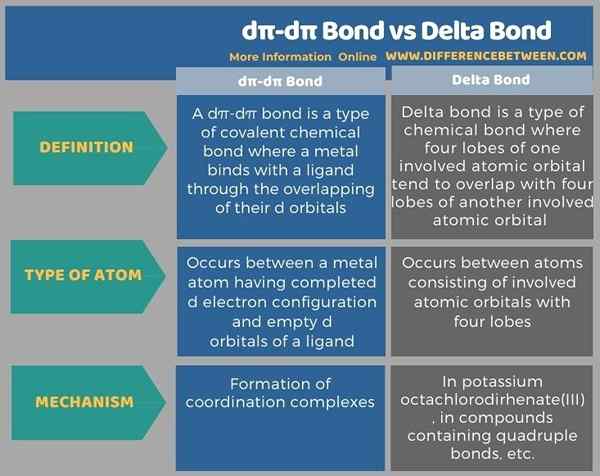
Resumen -enlace dπ -dπ vs delta
El enlace Dπ-Dπ y el enlace delta son dos tipos de enlaces químicos covalentes. La diferencia clave entre el enlace dπ-dπ y el enlace delta es que el enlace dπ-dπ se forma entre un orbital atómico d relleno y un orbital atómico d vacío, mientras que el enlace delta se forma entre cuatro lóbulos de un orbital atómico y cuatro lóbulos de otro involucrado.
Imagen de cortesía:
1. "COA6CL3" - Supuesto SmokeFoot - No se proporciona una fuente legible por máquina. Trabajo propio asumido (basado en reclamos de derechos de autor). (Dominio público) a través de Commons Wikimedia
2. "Delta-Bond-Formation-2D" por Ben Mills-Trabajo propio (dominio público) a través de Commons Wikimedia


