Diferencia entre la deshidratación por H2SO4 y H3PO4
El diferencia clave entre la deshidratación por H2SO4 y H3PO4 es que La deshidratación por H2SO4 es menos segura y facilita una reacción compleja, mientras que la deshidratación de H3PO4 es más segura y facilita una reacción menos compleja.
La deshidratación es básicamente la eliminación de H2O. La deshidratación de etanol y otros alcoholes se puede hacer usando dos catalizadores ácidos diferentes: ácido sulfúrico (H2SO4) y ácido fosfórico (V) (H3PO4). En este proceso, el etanol se deshidrata para obtener un producto alqueno.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es la deshidratación por H2SO4?
3. ¿Qué es la deshidratación por H3PO4?
4. Comparación lado a lado: deshidratación por H2SO4 vs H3PO4 en forma tabular
5. Resumen
¿Qué es la deshidratación por H2SO4??
La deshidratación por H2SO4 es un proceso químico que es útil para formar alquenos de alcoholes usando ácido sulfúrico como catalizador de ácido. Por lo tanto, esta reacción incluye la formación de un compuesto insaturado de un compuesto saturado. En otras palabras, los reactivos de esta reacción tienen solo enlaces individuales, mientras que los productos de esta reacción tienen enlaces individuales y dobles.
El ácido sulfúrico es un catalizador de ácido para la deshidratación de los alcoholes. En este proceso, debemos usar ácido sulfúrico concentrado. Sin embargo, el uso de este catalizador ácido da resultados algo desordenados. Se debe a que el ácido sulfúrico es un agente oxidante muy fuerte, y puede reducir algunos de los alcoholes para dar gas de dióxido de carbono y reducirse para producir gases con dióxido de azufre. Por lo tanto, ambos gases ocurren como contaminantes en el producto final y deben eliminarse. Además, también hay algunas otras reacciones; Por ejemplo, el ácido sulfúrico reacciona con alcohol para dar una masa de carbono.
En el proceso de deshidratación, el alcohol se calienta con ácido sulfúrico en estado concentrado. Aquí, se debe usar una cantidad excesiva de ácido sulfúrico para asegurarse de que todos los alcoholes reaccionen con el ácido. Se puede usar una solución de hidróxido de sodio para eliminar los gases no deseados producidos en esta reacción.
¿Qué es la deshidratación por H3PO4??
La deshidratación por H3PO4 es un proceso químico que es útil para formar alquenos de los alcoholes utilizando ácido fosfórico (V) como un catalizador ácido. Por lo tanto, esta reacción incluye la formación de un compuesto insaturado de un compuesto saturado. En otras palabras, los reactivos de esta reacción tienen solo enlaces individuales, mientras que los productos de esta reacción tienen enlaces individuales y dobles.
Figura 02: Reacción de deshidratación
Similar al método discutido anteriormente, este método también requiere el catalizador ácido en su estado concentrado. También necesitamos usar una cantidad excesiva de ácido fosfórico (V) para asegurarnos de que todas las moléculas de alcohol sean reaccionadas con el catalizador ácido para dar el alqueno deseado. Además, la deshidratación usando ácido fosfórico se usa principalmente en la producción de alquenos de estado líquido. La principal ventaja de esta reacción sobre la deshidratación por el ácido sulfúrico es que esta reacción no da resultados desordenados y es relativamente seguro (no se producen productos nocivos, e.gramo. El dióxido de azufre producido cuando se usa ácido sulfúrico, ya que el catalizador de ácido es un producto dañino).
¿Cuál es la diferencia entre la deshidratación por H2SO4 y H3PO4??
La deshidratación por H2SO4 es un proceso químico que es útil para formar alquenos de alcoholes usando ácido sulfúrico como catalizador de ácido. La deshidratación por H3PO4 es un proceso químico que es útil para formar alquenos de los alcoholes utilizando ácido fosfórico (V) como un catalizador ácido. La diferencia clave entre la deshidratación por H2SO4 y H3PO4 es que la deshidratación por H2SO4 es menos segura y facilita una reacción compleja, mientras que la deshidratación por H3PO4 es más segura y facilita una reacción menos compleja.
A continuación, la infografía tabula más comparaciones para discernir la diferencia entre la deshidratación por H2SO4 y H3PO4.

Resumen -Deshidratación por H2SO4 vs H3PO4
La deshidratación de etanol y otros alcoholes se puede hacer usando dos catalizadores ácidos diferentes; ácido sulfúrico y ácido fosfórico (V). La diferencia clave entre la deshidratación por H2SO4 y H3PO4 es que la deshidratación por H2SO4 es menos segura y facilita una reacción compleja, mientras que la deshidratación por H3PO4 es más segura y facilita una reacción menos compleja.
Imagen de cortesía:
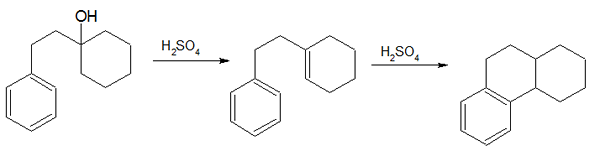
1. "Síntesis de Bogert -Cook" de Mephisto Spa - Trabajo propio (dominio público) a través de Commons Wikimedia
2. "Dianhidruro de etilenetetracarboxílico a través de la deshidratación de ácido" por DMACKS (charla) - Trabajo propio (dominio público) a través de Commons Wikimedia


