Diferencia entre deslocalización y resonancia
El diferencia clave Entre la delocalización y la resonancia es que La deslocalización se refiere a que los electrones se distribuyen en toda la área de una molécula en lugar de unirse a una sola molécula, mientras que la resonancia se refiere a la estabilización de una molécula debido a la deslocalización de electrones.
La deslocalización y la resonancia son conceptos químicos relacionados; El efecto de resonancia se explica utilizando la delocalización de electrones de los compuestos químicos.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es la delocalización?
3. ¿Qué es la resonancia?
4. Comparación de lado a lado - Deslocalización vs resonancia en forma tabular
5. Resumen
¿Qué es la delocalización??
La deslocalización es un término que se refiere a la distribución de electrones PI que no tienen un sintonismo a través de una molécula. Por lo tanto, podemos describir los electrones delocalizados como los electrones no frases en ese compuesto químico. El término deslocalización se refiere a electrones que no están asociados con un solo átomo o un enlace covalente. Sin embargo, el término electrón delocalizado tiene diferentes significados en diferentes campos. Por ejemplo, en la química orgánica, los electrones delocalizados están en las estructuras de resonancia de los sistemas conjugados en compuestos aromáticos. Del mismo modo, en la física de estado sólido, los electrones delocalizados son los electrones libres que facilitan la conducción eléctrica. Además, la física cuántica usa el término electrones delocalizados para referirse a electrones orbitales moleculares que se han extendido sobre varios átomos.

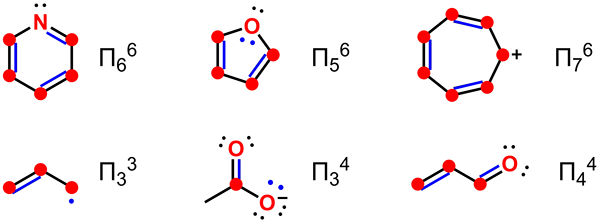
Figura 01: Deslocalización de electrones en moléculas
El ejemplo más simple que podemos dar para un sistema aromático que tiene electrones delocalizados es el anillo de benceno. El anillo de benceno tiene seis electrones PI en la molécula de benceno; a menudo indicamos estos usando gráficamente un círculo. Este círculo significa que los electrones PI están asociados con todos los átomos en la molécula. Esta delocalización hace que el anillo de benceno tenga enlaces químicos con longitudes de enlace similares.
¿Qué es la resonancia??
La resonancia es un concepto en química que describe la interacción entre los pares de electrones solitarios y los pares de electrones de un compuesto. El efecto de resonancia ayuda a determinar la estructura química real de ese compuesto orgánico o inorgánico. Este efecto aparece en compuestos que tienen dobles enlaces y pares de electrones solitarios. Además, este efecto provoca la polaridad de las moléculas.
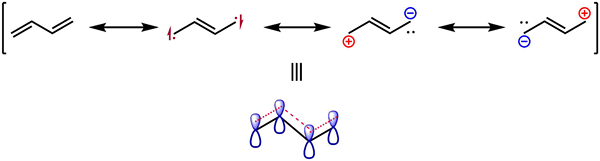
Figura 02: Estructuras de resonancia del butadieno
El efecto de resonancia muestra la estabilización de un compuesto químico a través de electrones delocalización en enlaces PI. En general, los electrones en las moléculas pueden moverse alrededor de los núcleos atómicos, ya que un electrón no tiene una posición fija dentro de los átomos. Por lo tanto, los pares de electrones solitarios pueden moverse a enlaces PI y viceversa. Esto sucede para obtener un estado estable. Este proceso de movimiento de electrones se conoce como resonancia. Además, podemos usar estructuras de resonancia para obtener la estructura más estable de una molécula.
Una molécula puede tener varias estructuras de resonancia basadas en el número de pares solitarios y enlaces PI presentes en esa molécula. Todas las estructuras de resonancia de una molécula tienen el mismo número de electrones y la misma disposición de átomos. La estructura real de esa molécula es una estructura híbrida en todas las estructuras de resonancia. Hay dos tipos de efecto de resonancia: efecto de resonancia positiva y efecto de resonancia negativa.
El efecto de resonancia positiva explica la resonancia que se puede encontrar en compuestos que tienen una carga positiva. El efecto de resonancia positiva ayuda a estabilizar la carga positiva en esa molécula. El efecto de resonancia negativa explica la estabilización de una carga negativa en una molécula. Sin embargo, la estructura híbrida que se obtiene teniendo en cuenta la resonancia tiene menor energía que todas las estructuras de resonancia.
¿Cuál es la diferencia entre desalocalización y resonancia??
La deslocalización y la resonancia son dos conceptos químicos relacionados. La diferencia clave entre la deslocalización y la resonancia es que la desalocalización se refiere a que los electrones se distribuyen en toda la área de una molécula en lugar de unirse a una sola molécula, mientras que la resonancia se refiere a la estabilización de una molécula debido a la delocalización de electrones.
Además, la deslocalización ocurre en moléculas que tienen enlaces individuales alternativos y enlaces dobles o enlaces triples, mientras que la resonancia ocurre en sistemas conjugados, o moléculas que tienen cargas eléctricas móviles.
Debajo de la infografía resume las diferencias entre la delocalización y la resonancia.
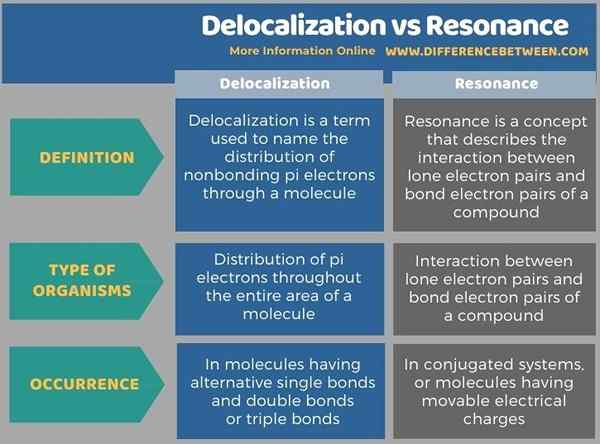
Resumen -Deslocalización vs resonancia
La deslocalización y la resonancia son conceptos químicos relacionados; El efecto de resonancia se explica utilizando la delocalización de electrones de los compuestos químicos. La diferencia clave entre la deslocalización y la resonancia es que la desalocalización se refiere a los electrones que se distribuyen en todo el área de una molécula en lugar de unirse a una sola molécula, mientras que la resonancia se refiere a la estabilización de una molécula debido a la delocalización de electrones.
Referencia:
1. "Deslocalización de electrones."Bibliotecas. Disponible aquí.
Imagen de cortesía:
1. "Deslocalización actualizada" por Alsosaid1987-Trabajo propio (CC BY-SA 4.0) a través de Commons Wikimedia
2. "Butadiene-Resonance" de Alsosaid1987-Trabajo propio (CC By-SA 4.0) a través de Commons Wikimedia


