Diferencia entre deuterio y tritio
El diferencia clave Entre Deuterium y Tritium es que El núcleo de deuterio tiene un neutrón, mientras que el núcleo del tritio tiene dos neutrones.
El hidrógeno es el primer y más pequeño elemento en la tabla periódica, que denotamos como h. Tiene un electrón y un protón. Podemos clasificarlo en el grupo 1 y el período 1 en la tabla periódica debido a su configuración de electrones: 1S1. El hidrógeno puede tomar un electrón para formar un ion cargado negativamente, o puede donar fácilmente el electrón para producir un protón cargado positivamente. Si no, puede compartir el electrón para hacer enlaces covalentes. Debido a esta capacidad, el hidrógeno está presente en una gran cantidad de moléculas, y es un elemento altamente abundante en la tierra. El hidrógeno tiene tres isótopos como protio-1H (sin neutrones), Deuterium-2H (un neutrón) y tritio 3H (dos neutrones). El protio es el más abundante entre estos tres, que tiene alrededor del 99% de abundancia relativa.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es deuterio?
3. Que es tritio
4. Comparación de lado a lado - Deuterium vs tritio en forma tabular
5. Resumen
¿Qué es deuterio??
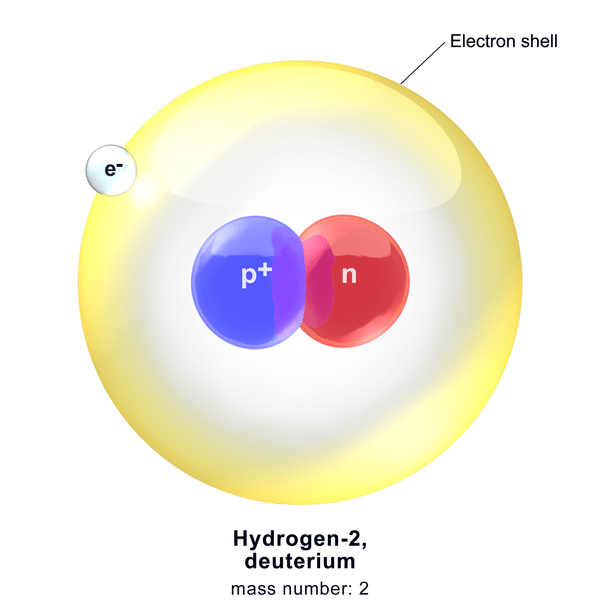
Deuterio es uno de los isótopos de hidrógeno. Es un isótopo estable con 0.015% Abundancia natural. Hay un protón y un neutrón en el núcleo de Deuterium. Por lo tanto, su número de masa es dos, y el número atómico es uno. Llamamos a este isótopo como hidrógeno pesado y se muestra como 2h. Sin embargo, más comúnmente, lo representamos con D.

Figura 1: Deuterio
El deuterio puede existir como una molécula gaseosa diatómica con la fórmula química D2. Sin embargo, la posibilidad de unir dos átomos de D en la naturaleza es baja debido a la menor abundancia de la misma. Por lo tanto, este isótopo se une principalmente con un átomo de 1H que hace un gas -HD (deuterida de hidrógeno). Además, dos átomos de deuterio pueden unirse con oxígeno para formar el análogo de agua D2O, que llamamos agua pesada.
Además, las moléculas con deuterio muestran diferentes propiedades químicas y físicas que el análogo de hidrógeno de ellas. Por ejemplo, puede exhibir un efecto de isótopos cinéticos. Además, los compuestos deuterados muestran diferencias características en la RMN, IR y la espectroscopía de masas; Por lo tanto, podemos identificarlo utilizando esos métodos. Además, Deuterium tiene un giro de uno. Por lo tanto, en RMN, el acoplamiento de este isótopo da un triplete. Además, absorbe una frecuencia IR diferente que el hidrógeno en la espectroscopía IR. Debido a la gran diferencia de masa, en la espectroscopía de masas, el deuterio se puede distinguir del hidrógeno.
Que es tritio?
El tritio es el isótopo de hidrógeno cuyo número de masa es tres. Por lo tanto, el núcleo del tritio tiene un protón y dos neutrones. Solo existe en la cantidad traza en la naturaleza debido a su radiactividad. Por esta razón, debe producirse artificialmente para un uso práctico.
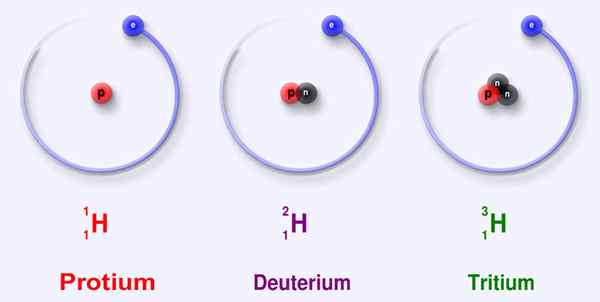
Figura 02: Tres isótopos principales de hidrógeno
El tritio es un isótopo radiactivo (este es el único isótopo radiactivo de hidrógeno). Tiene una vida media de 12 años, y decae emitiendo una partícula beta para producir helio-3. La masa atómica de este isótopo es 3.0160492. Además, existe como un gas (HT) a temperatura y presión estándar. Además, puede formar el óxido (HTO), que llamamos "agua tritiada."El tritio es útil para fabricar armas nucleares y como trazador en estudios biológicos y ambientales.
¿Cuál es la diferencia entre Deuterium y Tritium??
Deuterio y tritio son dos isótopos de hidrógeno. La diferencia clave entre el deuterio y el tritio es que el núcleo de deuterio tiene un neutrón, mientras que el núcleo del tritio tiene dos neutrones. Además, el número de masa de Deuterium es 2.0135532 mientras que el número de masa de tritio es 3.0160492. Entonces, esta es otra diferencia significativa entre Deuterium y Tritium.
Además, una diferencia adicional entre Deuterium y Tritium es que el Deuterium es un isótopo estable y podemos encontrarlo en la naturaleza, mientras que el tritio es un isótopo radiactivo que no podemos encontrarlo en la naturaleza. Sin embargo, podemos producirlo artificialmente para un uso práctico.

Resumen -Deuterium vs Tritium
Deuterio y tritio son isótopos del elemento químico hidrógeno. La diferencia clave entre deuterio y tritio es que el núcleo de deuterio tiene un neutrón, mientras que el núcleo del tritio tiene dos neutrones. Además, el tritio es radiactivo, mientras que Deuterium es un isótopo estable.
Referencia:
1. Helmenstine, Anne Marie, PH.D. "Hechos de Deuterium."Thinkco, abril. 2, 2019, disponible aquí.
Imagen de cortesía:
1. "Blausen 0527 Hydrogen -2 Deuterium" por Bruceblaus - Trabajo propio (CC por 3.0) a través de Commons Wikimedia
2. "Protium Deuterium Tritium" de Lamiot para la versión francesa, de Dirk Hünniger - Self, traducción de Dirk Hünniger (Wikipedia alemana) (CC By -Sa 3.0) a través de Commons Wikimedia


