Diferencia entre el grafito de diamantes y el fullerene

El diferencia clave Entre el grafito de diamante y el fullerene es que Diamond tiene una estructura de cristal cúbico de diamantes y el grafito tiene una estructura cristalina hexagonal, mientras que el fullereno ocurre como una molécula esferoidal grande.
Diamond, grafito y fullereno son diferentes alotropas del elemento químico de carbono. Todos estos compuestos solo tienen átomos de carbono en la composición, pero la disposición de los átomos de carbono difiere entre sí.
CONTENIDO
1. Descripción general y diferencia de claves
2. Que es el diamante
3. ¿Qué es el grafito?
4. Que es fullerene
5. Comparación de lado a lado - Diamante vs grafito vs fullereno en forma tabular
6. Resumen
Que es el diamante?
Diamond es una alotrape de carbono, que tiene la estructura de cristal cúbico de diamantes. Está en el estado sólido a temperatura y presión estándar. Además, tiene la mayor dureza entre todos los materiales y la conductividad térmica más alta también. Los diamantes caen en la categoría de minerales nativos, y típicamente su color es amarillo, marrón o gris a incoloro. Además, la escisión de este material es perfecta en cuatro direcciones, y la fractura es irregular. La racha mineral de un diamante es incoloro. Al considerar las propiedades ópticas, el diamante es isotrópico.

Figura 01: Diamante
En este material, los átomos de carbono son SP3 hibbridado. Cada átomo forma un tetraédrico con otro átomo. Las estructuras tetraédricas son rígidas, y los enlaces entre los átomos son muy fuertes. Además, Diamond tiene el mayor número de átomos en un volumen unitario del material.
¿Qué es el grafito??
El grafito es una alotrape de carbono que tiene la estructura de cristal hexagonal. El compuesto ocurre naturalmente como minerales de grafito; Entonces, podemos obtener este material a través de la minería. Es la alotrape más estable de carbono a temperatura y presión estándar. Además, en condiciones de temperatura y presión muy altas, el grafito puede convertirse en diamante. Tiene una alta conductividad eléctrica.

Figura 02: Grafito
Graphite también se encuentra en la categoría de minerales nativos. El color puede variar de hierro-negro a acero-gris. Además, la escisión de este material es basal, y la fractura es escamosa. La dureza es muy baja, y tiene un brillo metálico y terroso. La racha mineral de grafito es negra. Al considerar las propiedades ópticas, el grafito es uniaxial.
Que es fullerene?
Fullerene es una alotropra de carbono que tiene una gran estructura esférica. Los átomos de carbono en esta alotropra se conectan entre sí a través de enlaces individuales y dobles. Además, la estructura esférica es una malla cerrada o parcialmente cerrada que tiene anillos fusionados que contienen 5 a 7 átomos de carbono. Ellos son sp2 átomos hibridados. Sin embargo, la estructura tiene una tensión ángulo entre los átomos.
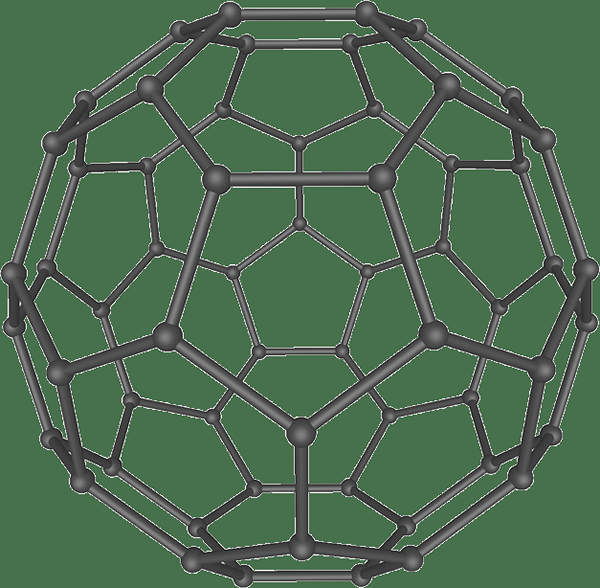
Figura 03: Estructura de la esfera de fullereno
Además, los fullerenos son solubles en solventes orgánicos, que incluyen tolueno, clorobenceno, etc. En general, este material es un aislante eléctrico.
¿Cuál es la diferencia entre Diamond Graphite y Fullerene??
Diamante, grafito y fullerene son alotropos de carbono. La diferencia clave entre el grafito de diamantes y el fullereno es que el diamante tiene una estructura de cristal cúbico de diamantes y el grafito tiene una estructura de cristal hexagonal, mientras que el fullereno se produce como una gran molécula esferoidal. Además, el diamante es el material más duro de la tierra, pero el grafito y el fullereno tienen dureza relativamente baja.
Además, una diferencia adicional entre el grafito de diamantes y el fullereno es que los átomos de carbono de un diamante son SP3 Hibridado pero, en grafito y fullerene, son sp2 hibbridado. Al considerar la geometría alrededor de un átomo de carbono, en diamante, es tetraédrico y en grafito, es un plano trigonal mientras, en plenoereno, es esférico.

Resumen -Diamond vs Graphite vs Fullerene
Diamante, grafito y fullerene son alotropos de carbono. En resumen, la diferencia clave entre el grafito de diamante y el fullereno es que el diamante tiene una estructura de cristal cúbico de diamante y el grafito tiene una estructura de cristal hexagonal, mientras que el fullereno se produce como una molécula esferoidal grande.
Referencia:
1. "Grafito."Geología, disponible aquí.
2. "Diamante."Wikipedia, Fundación Wikimedia, 13 de julio de 2019, disponible aquí.
Imagen de cortesía:
1. "Diamantes y diamantes de Vickers" por R. Tanaka -(CC por 3.0) a través de Commons Wikimedia
2. "Graphite-233436" de Rob Lavinsky, Iroocks.com - (cc by -sa 3.0) a través de Commons Wikimedia
3. "C60a" - El cargador original fue Mstroeck en English Wikipedia.Bryn C cargó versiones posteriores en EN.Wikipedia. - Transferido desde EN.Wikipedia a Commons (CC By-SA 3.0) a través de Commons Wikimedia


