Diferencia entre diastereómeros y enantiómeros
El diferencia clave entre diastereómeros y enantiómeros es que Los diastereómeros de una molécula no son imágenes espejo entre sí, mientras que los enantiómeros son imágenes espejo entre sí.
Puede haber varias fórmulas estructurales para una sola fórmula molecular. Estos se conocen como isómeros. Podemos definir los isómeros como "diferentes compuestos que tienen la misma fórmula molecular."Existen principalmente dos tipos de isómeros: isómeros constitucionales y estereoisómeros. Los diastereómeros y los enantiómeros son los dos tipos de estereoisómeros.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué son los diastereómeros?
3. ¿Qué son los enantiómeros?
4. Comparación de lado a lado: diastereomers vs enantiómeros en forma tabular
5. Resumen
¿Qué son los diastereómeros??
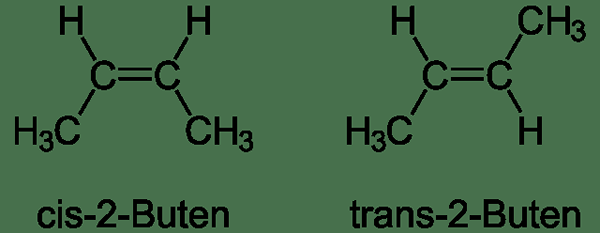
Los diastereómeros son estereoisómeros cuyas moléculas no son imágenes espejo entre sí. Por ejemplo, los isómeros cis y trans son diastereomers. Aquí, la conectividad de los átomos es la misma.

Figura 01: diastereomers
En el ejemplo anterior, ambos compuestos tienen un doble enlace de carbono-carbono. Para cada carbono, un grupo metilo y un átomo de hidrógeno están conectados. Las moléculas cis y trans difieren solo de la forma en que los átomos están dispuestos en el espacio. Es decir, en el isómero cis, ambos hidrógenos están en el mismo lado del doble enlace de carbono. Sin embargo, en el isómero trans, los átomos de hidrógeno están a ambos lados del doble enlace de carbono. Además, las dos estructuras no son imágenes espejo entre sí. Por lo tanto, son diastereómeros. Sin embargo, las moléculas cis y trans no son el único tipo de diastereómeros que podemos encontrar.
¿Qué son los enantiómeros??
Los enantiómeros son estereoisómeros cuyas moléculas son imágenes de espejo no superposibles entre sí. Los enantiómeros solo son posibles con moléculas que son quirales. Una molécula quiral es una que no es idéntica a su imagen de espejo. Para que una molécula sea quiral, debe tener un átomo de carbono tetraédrico con cuatro grupos diferentes unidos a ella. Este átomo de carbono se conoce como un estereocentro. Las moléculas quirales hacen imágenes de espejo que no son superponibles. Por lo tanto, la molécula y la imagen del espejo son enantiómeros entre sí. El siguiente es un ejemplo de un compuesto que forma enantiómeros.
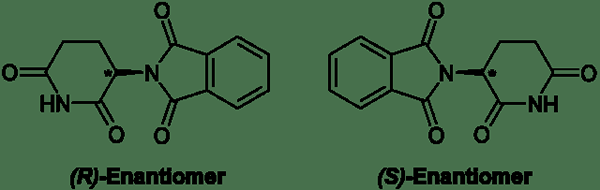
Figura 02: Enantiómeros
Suele nombrar enantiómeros usando el sistema R y S. Los enantiómeros no tienen diferentes puntos de ebullición, puntos de fusión, solubilidades, diferentes espectros infrarrojos, etc. Todas estas propiedades químicas y físicas de los enantiómeros son similares porque las fuerzas intermoleculares son similares en ambos isómeros. Se separan solo por sus diferentes comportamientos hacia la luz polarizada en plano. Es decir, los enantiómeros giran el plano de la luz polarizada en plano en direcciones opuestas. Sin embargo, giran la luz en cantidades iguales. Debido a su efecto sobre la luz polarizada, los enantiómeros son ópticamente activos. La mezcla equimolar de dos enantiómeros es una mezcla racémica. Una mezcla racémica no muestra ninguna rotación de la luz polarizada; Por lo tanto, está ópticamente inactivo.
¿Cuál es la diferencia entre diastereómeros y enantiómeros??
La diferencia clave entre diastereómeros y enantiómeros es que los diastereómeros de una molécula no son imágenes espejo entre sí, mientras que los enantiómeros son imágenes espejo. Las moléculas con más de un estereocentro pueden ser diastereómeros si no son imágenes espejo entre sí. Sin embargo, si solo hay un estereocentro, entonces esa molécula tiene enantiómeros. Los diastereómeros tienen diferentes propiedades físicas y químicas. Pero los enantiómeros tienen propiedades físicas y químicas similares, excepto por sus diferentes propiedades ópticas hacia la luz polarizada en plano.

Resumen -diastereomers vs enantiómicos
Los diastereómeros y los enantiómeros son los dos tipos de estereoisómeros. La diferencia clave entre diastereómeros y enantiómeros es que los diastereómeros de una molécula no son imágenes espejo entre sí, pero los enantiómeros son imágenes espejo.
Referencia:
1. Helmenstine, Anne Marie. "Definición de enantiómero."Thinkco, dec. 5, 2018, disponible aquí.
Imagen de cortesía:
1. "Cis-trans-2-buten" por Neurotiker-Trabajo propio (dominio público) a través de Commons Wikimedia
2. "Talidomida -Enantiómicos" de Klaus Hoffmeier - Trabajo propio (dominio público) a través de Commons Wikimedia


