Diferencia entre dilución y concentración
El diferencia clave entre la dilución y la concentración es que La dilución se refiere a la adición de más solvente, mientras que la concentración se refiere a la eliminación del solvente.
Los conceptos de dilución y concentración son muy significativos en el estudio de soluciones en química. En consecuencia, la cantidad de soluto en un solvente decide las propiedades de una solución y esta cantidad permanece la misma; Podemos hacer una solución "diluida" o "concentrada" agregando solvente y eliminando parte del solvente de la solución. Por lo tanto, en el análisis químico, necesitamos cambiar la concentración de una solución a menudo en diferentes aplicaciones.
CONTENIDO
1. Descripción general y diferencia de claves
2. Que es la dilución
3. ¿Qué es la concentración?
4. Comparación de lado a lado: dilución vs concentración en forma tabular
5. Resumen
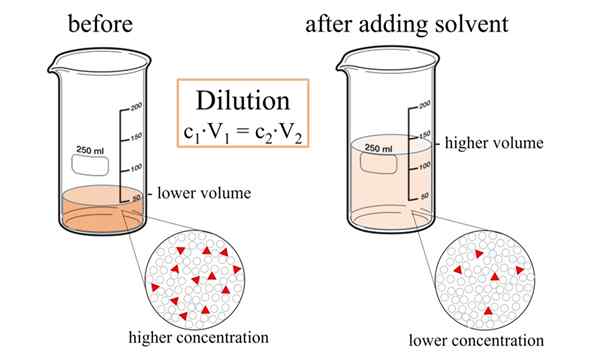
Que es la dilución?
La dilución es el proceso de disminución de la concentración de solutos en una solución al agregar más solvente. De este modo, podemos disminuir la cantidad de solutos presentes en un volumen unitario de la solución. Si nos referimos a "diluir", significa "agregar más solvente sin agregar solutos". Sin embargo, después de la adición del solvente, debemos mezclar completamente la solución para obtener una solución homogénea.

Figura 01: Proceso de dilución
Según la siguiente ecuación, podemos determinar la concentración final de la solución después del proceso de dilución.
C1V1 = C2V2
Donde, C1 es la concentración inicial, V1 es el volumen inicial de la solución, C2 es la concentración después de la dilución y V2 es la concentración final de la solución. Por ejemplo, si agregamos 5 ml de agua a 95 ml de una solución acuosa de NaCl (1 mol/L), entonces la dilución da un 0.Solución de 95 mol/L. Por lo tanto, la concentración se reduce.
¿Qué es la concentración??
La concentración es el proceso de aumentar la concentración de solutos en una solución. En otras palabras, está disminuyendo la cantidad de solvente o aumentando la cantidad de solutos. Por lo tanto, es el proceso de aumentar la cantidad de solutos presentes en un volumen unitario de la solución.

Figura 02: el proceso de concentración oscurece la solución '
Una solución concentrada contiene una gran cantidad de solutos en comparación con una solución diluida. Podemos determinar la concentración de la solución después de concentrarla usando la misma ecuación dada anteriormente (bajo la dilución subtópica).
¿Cuál es la diferencia entre dilución y concentración??
La dilución es el proceso de disminución de la concentración de solutos en una solución al agregar más solvente, mientras que la concentración es el proceso de aumentar la concentración de solutos en una solución. Por lo tanto, la diferencia clave entre la dilución y la concentración es que la dilución se refiere a la adición de más solvente, mientras que la concentración se refiere a la eliminación del solvente. Podemos diluir una solución agregando más solvente o eliminando los solutos, mientras que el proceso de concentración implica la adición de más solutos o la eliminación del solvente.
La siguiente infografía proporciona más detalles sobre la diferencia entre la dilución y la concentración.

Resumen -dilución vs concentración
La dilución y la concentración son muy importantes en la química para preparar una solución con la concentración deseada. Además, estos procesos de dilución y concentración son muy importantes en la química analítica. La diferencia clave entre la dilución y la concentración es que la dilución se refiere a la adición de más solvente, mientras que la concentración se refiere a la eliminación del solvente.
Referencia:
1. "Dilución (ecuación)."Wikipedia, Fundación Wikimedia, 22 de septiembre. 2018. Disponible aquí
Imagen de cortesía:
1."Dilución" por TheIslikerice - Trabajo propio, (CC BY -SA 4.0) a través de Commons Wikimedia
2."Ejemplo simple de concentración de dilución" de FirstPrinciples (dominio público) a través de Commons Wikimedia


