Diferencia entre las fuerzas de dispersión dipolo y dipolo y de Londres
Diferencia clave - Dipolo-Dipole vs Fuerzas de dispersión de Londres
Las fuerzas de dispersión de dipolo-Dipolo y Londres son dos fuerzas de atracción que se encuentran entre moléculas o átomos; Afectan directamente el punto de ebullición del átomo /molécula. El diferencia clave entre las fuerzas de dispersión dipolo y dipolo y de Londres es su fuerza y dónde se pueden encontrar. El La fuerza de las fuerzas de dispersión de Londres es relativamente más débil que las interacciones dipolo-dipolo; Sin embargo, ambas atracciones son más débiles que los enlaces iónicos o covalentes. Las fuerzas de dispersión de Londres se pueden encontrar en cualquier molécula o, a veces, en átomos, pero las interacciones dipolo-dipolo solo se encuentran en las moléculas polares.
¿Qué es la fuerza dipolo-dipolo??
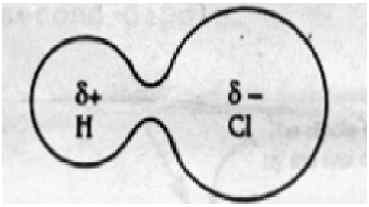
Las interacciones dipolo-dipolo ocurren cuando dos moléculas polarizadas opuestas interactúan a través del espacio. Estas fuerzas existen en todas las moléculas que son polares. Las moléculas polares se forman cuando dos átomos tienen una diferencia de electronegatividad cuando forman un enlace covalente. En este caso, los átomos no pueden compartir electrones uniformemente entre dos átomos debido a la diferencia de electronegatividad. El átomo más electronegativo atrae la nube de electrones más que el átomo menos electronegativo; de modo que la molécula resultante posee un extremo ligeramente positivo y un extremo ligeramente negativo. Los dipolos positivos y negativos en otras moléculas pueden atraer entre sí, y esta atracción se llama fuerzas dipolo-dipolo.

¿Qué es Londres? Fuerza de dispersión?
Las fuerzas de dispersión de Londres se consideran la fuerza intermolecular más débil entre las moléculas o átomos adyacentes. Las fuerzas de dispersión de Londres dan como resultado cuando hay fluctuaciones en la distribución de electrones en la molécula o átomo. Por ejemplo; Estos tipos de fuerzas de atracción surgen en átomos vecinos debido a un dipolo instantáneo en cualquier átomo. Induce dipolo en átomos vecinos y luego se atrae a través de fuerzas de atracción débiles. La magnitud de la fuerza de dispersión de Londres depende de la facilidad con la que los electrones en el átomo o en la molécula se pueden polarizar en respuesta a una fuerza instantánea. Son fuerzas temporales que pueden estar disponibles en cualquier molécula ya que tienen electrones.

¿Cuál es la diferencia entre las fuerzas de dispersión de dipolo y dipolo??
Definición:
Fuerza dipolo-dipolo: La fuerza dipolo-dipolo es la fuerza de atracción entre el dipolo positivo de una molécula polar y el dipolo negativo de otra molécula polarizada opuesta.
Fuerza de dispersión de Londres: La fuerza de dispersión de Londres es la fuerza atractiva temporal entre las moléculas o átomos adyacentes cuando hay fluctuación en la distribución de electrones.
Naturaleza:
Fuerza dipolo-dipolo: Las interacciones dipolo-dipolo se encuentran en moléculas polares como HCL, BRCL y HBR. Esto surge cuando dos moléculas comparten electrones de manera desigual para formar un enlace covalente. La densidad de electrones cambia hacia el átomo más electronegativo, lo que resulta en un dipolo ligeramente negativo en un extremo y un dipolo ligeramente positivo en el otro extremo.
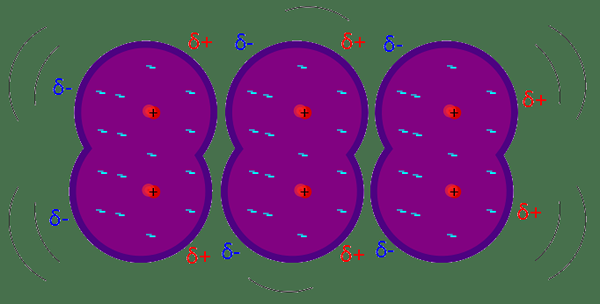
Fuerza de dispersión de Londres: Las fuerzas de dispersión de Londres se pueden encontrar en cualquier átomo o molécula; El requisito es una nube de electrones. Las fuerzas de dispersión de Londres también se encuentran en moléculas no polares y átomos.
Fortaleza:
Fuerza dipolo-dipolo: Las fuerzas dipolo-dipolo son más fuertes que las fuerzas de dispersión pero más débiles que los enlaces iónicos y covalentes. La resistencia promedio de las fuerzas de dispersión varía entre1-10 kcal/mol.
Fuerza de dispersión de Londres: Son débiles porque las fuerzas de dispersión de Londres son fuerzas temporales (0-1 kcal/mol).
Factores que afectan:
Fuerza dipolo-dipolo: Los factores que afectan la resistencia de las fuerzas dipolo-dipolo son la diferencia de electronegatividad entre los átomos en la molécula, el tamaño molecular y la forma de la molécula. En otras palabras, cuando la longitud de enlace aumenta la interacción dipolo disminuye.
Fuerza de dispersión de Londres: La magnitud de las fuerzas de dispersión de Londres depende de varios factores. Aumenta con el número de electrones en el átomo. La polarización es uno de los factores importantes que afectan la fuerza en las fuerzas de dispersión de Londres; Es la capacidad de distorsionar la nube de electrones por otro átomo/molécula. Las moléculas que tienen electronegatividad menor y radios más grandes tienen una mayor polarización. A diferencia de; Es difícil distorsionar la nube de electrones en átomos más pequeños, ya que los electrones están muy cerca del núcleo.
Ejemplo:
| Átomo | Punto de ebullición / OC | |
| Helio | (Él) | -269 |
| Neón | (Nordeste) | -246 |
| Argón | (Arkansas) | -186 |
| Criptón | (KR) | -152 |
| Xenón | (Xe) | -107 |
| Redon | (RN) | -62 |
Rn- cuanto más grande es el átomo, fácil de polarizar (mayor polarización) y posee las fuerzas atractivas más fuertes. El helio es muy pequeño y difícil de distorsionar y provoca fuerzas de dispersión de Londres más débiles.
Imagen de cortesía:
1. Dipolo-Dipole-Interacción en HCL-2D por Benjah-BMM27 (trabajo propio) [Dominio público], a través de Wikimedia Commons
2. Forze di London por Riccardo Rovinetti (Trabajo propio) [CC BY-SA 3.0], a través de Wikimedia Commons


