Diferencia entre la disociación y la solvatación
El diferencia clave entre la disociación y la solvatación es que La disociación es la descomposición de una sustancia en los átomos o iones de los cuales se hace la sustancia, mientras que la solvatación es la disolución de una sustancia en un solvente debido a las fuerzas de atracción entre las moléculas de solvente y los componentes de la sustancia.
La disociación y la solvatación a menudo se encuentran en la química analítica y en la química inorgánica, con respecto al desglose de sustancias químicas sobre diferentes interacciones entre átomos e iones en una sustancia.
CONTENIDO
1. Descripción general y diferencia de claves
2. Que es la disociación
3. Que es la solvatación
4. Comparación de lado a lado: disociación frente a solvatación en forma tabular
5. Resumen
Que es la disociación?
El término disociación se refiere a la descomposición o división de un compuesto en partículas más pequeñas. El proceso de disociación forma productos que están cargados eléctricamente o neutros. Eso significa; Los productos de disociación pueden ser iónicos o no iónicos. Sin embargo, esto no implica la ganancia o pérdida de electrones por los átomos.
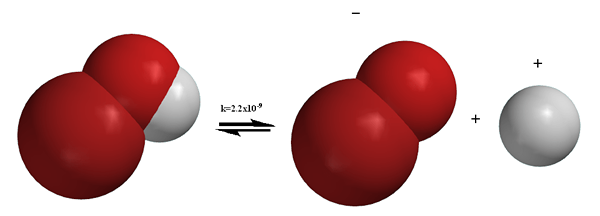
Figura 01: Disociación de la molécula de Broh
En contraste con el proceso de ionización, la disociación implica la separación de iones que ya existían en un compuesto. A veces, la disociación también puede producir partículas neutrales, por ejemplo, la descomposición de N2O4 resulta en la producción de dos moléculas de NO2. Los procesos de disociación son reversibles la mayoría de las veces. Eso significa que los iones separados se pueden reorganizar para producir el compuesto anterior. Por ejemplo, como se mencionó anteriormente, la disolución de NaCl es un proceso de disociación, y produce dos partículas cargadas. Pero, el NaCl sólido se puede obtener nuevamente con las condiciones adecuadas, lo que demuestra que la disociación es reversible. A diferencia de la ionización, la disociación tiene lugar en los compuestos iónicos.
Que es la solvatación?
La solvatación es la disolución de una sustancia en un solvente particular. La solvatación ocurre debido a la fuerza de atracción entre las moléculas del solvente y las moléculas de soluto. Por lo general, las fuerzas de atracción involucradas en este proceso son enlaces iónicos y atracciones de enlaces de hidrógeno. Estas fuerzas de atracción causan la disolución de un soluto en un solvente.

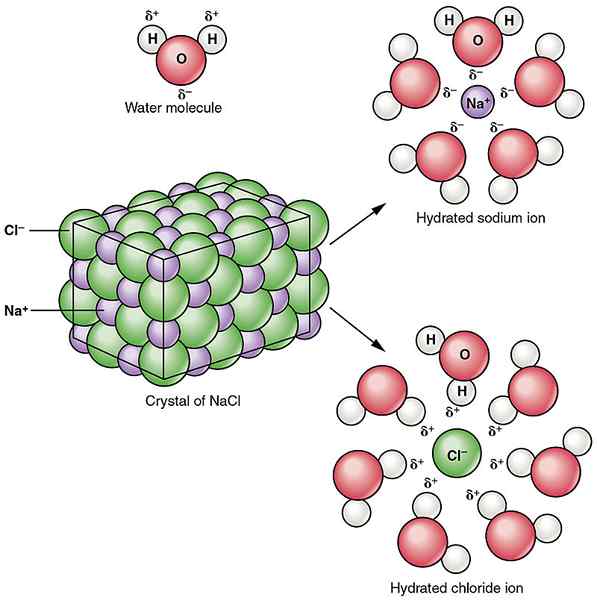
Figura 02: solvatación del compuesto iónico de cloruro de sodio en agua
Las interacciones iónicas-dipolo se pueden encontrar entre compuestos iónicos y solventes polares. mi.gramo. El agua es un disolvente polar. Cuando se agrega cloruro de sodio al agua, las moléculas de agua polar atraen los iones de sodio y los iones de cloruro por separado, lo que hace que los iones de sodio y cloruro se separen. Esto da como resultado la descomposición del compuesto iónico de cloruro de sodio.
¿Cuál es la diferencia entre disociación y solvatación??
La disociación y la solvatación son términos que describen cómo las diferentes sustancias se dividen en piezas pequeñas o átomos/iones dependiendo de las interacciones. La diferencia clave entre la disociación y la solvatación es que la disociación es la descomposición de una sustancia en los átomos o iones de los que se hace la sustancia, mientras que la solvatación es la disolución de una sustancia en un solvente debido a las fuerzas de atracción entre las moléculas de solvente y los componentes de la sustancia.
La tabulación a continuación muestra más diferencias entre la disociación y la solvatación.
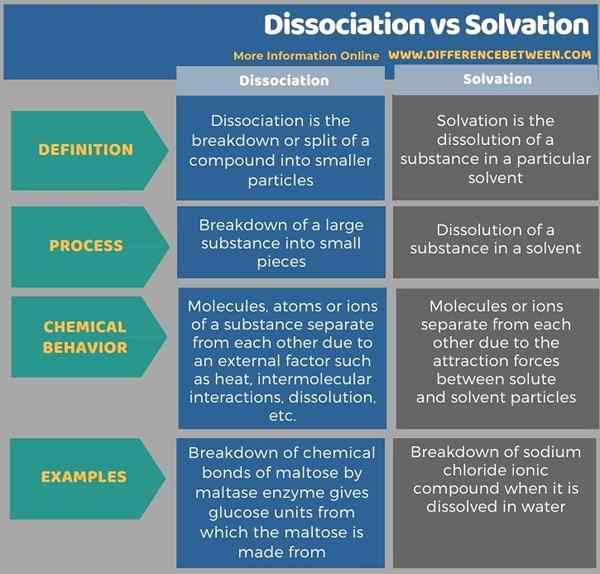
Resumen -Disociación vs solvatación
La diferencia clave entre la disociación y la solvatación es que la disociación es la descomposición de una sustancia en los átomos o iones de los que se hace la sustancia, mientras que la solvatación es la disolución de una sustancia en un solvente debido a las fuerzas de atracción entre las moléculas de solvente y los componentes de la sustancia.
Referencia:
1. "Soluciones, solvatación y disociación."Bibliotecas de química, Librettexts, 5 de junio de 2019, disponible aquí.
2. "Solvación y disociación."Socrático.org, disponible aquí.
Imagen de cortesía:
1. "Disociación de ácido de Broh" por ACHOW801 - Trabajo propio (CC By -SA 4.0) a través de Commons Wikimedia
2. "214 Disociación de cloruro de sodio en el agua -01" por OpenStax College - Anatomía y fisiología, Sitio web de Connexions, 19 de junio de 2013 (CC por 3.0) a través de Commons Wikimedia


