Diferencia entre el doble enlace y el enlace único
El diferencia clave entre el doble enlace y el enlace único es que, En una sola formación de enlaces, Dos átomos comparten Un par de electrones solo entre mientras, en una formación de doble enlace, dos átomos comparten dos pares de electrones.
Según lo propuesto por el químico estadounidense g.norte.Lewis, los átomos son estables cuando contienen ocho electrones en su carcasa de valencia. La mayoría de los átomos tienen menos de ocho electrones en sus conchas de valencia (excepto los gases nobles en el grupo 18 de la tabla periódica); Por lo tanto, no son estables. Estos átomos tienden a reaccionar entre sí, a ser estables. Por lo tanto, cada átomo puede lograr una configuración electrónica de gas noble. Y esto puede suceder formando enlaces iónicos, enlaces covalentes o enlaces metálicos. Entre estos, la unión covalente es especial. Los enlaces individuales y dobles se encuentran en esta categoría de bonos.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es el doble enlace?
3. ¿Qué es un solo enlace?
4. Comparación de lado a lado: doble enlace vs un solo enlace en forma tabular
5. Resumen
¿Qué es el doble enlace??
Forma de doble enlace cuando dos átomos comparten dos pares de electrones entre ellos para llenar los orbitales de valencia. Los enlaces dobles son más cortos que los enlaces individuales pero más fuertes que ellos. Sp2 La hibridación permite que los átomos formen dobles enlaces.
Los enlaces dobles pueden ser de dos tipos. De los dos enlaces, uno es un vínculo Sigma. Se forma a través de la superposición lineal de dos sp2 orbitales hibridados. En segundo lugar, el otro enlace (que nombramos como el enlace Pi) se forma a través de la superposición lateral de dos orbitales P.
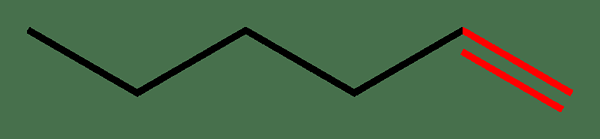
Figura 01: doble enlace en color rojo
El ejemplo común de una molécula con un doble enlace es el etileno. En etileno, el doble enlace es entre dos átomos de carbono. Sin embargo, aparte de entre átomos similares, este tipo de enlaces también puede formarse entre diferentes átomos como en los ejemplos del carbono carbonilo (C = O), iminas (C = N), compuestos AZO (N = N), etc.
¿Qué es un solo enlace??
Forma de enlace único cuando dos átomos con diferencia de electronegatividad similar o baja comparten un par de electrones. Estos dos átomos pueden ser del mismo tipo o diferentes tipos. Por ejemplo, cuando el mismo tipo de átomos se une para formar moléculas como CL2, H2, o P4, Cada átomo se une con otro por un solo enlace covalente.
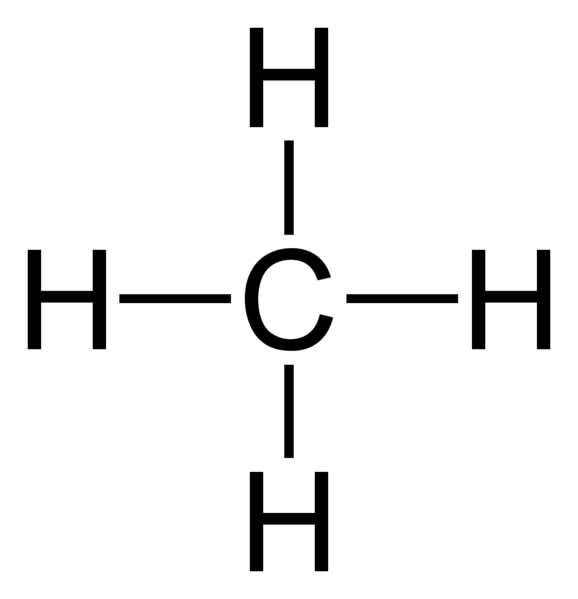
Molécula de metano (CH4) tiene un solo enlace covalente entre dos tipos de elementos (átomos de carbono e hidrógeno). Además, el metano es un ejemplo para una molécula que tiene enlaces covalentes entre átomos con muy baja diferencia de electronegatividad.

Figura 02: Estructura de la molécula de metano
Nombramos los enlaces covalentes individuales también como enlaces Sigma. Un solo enlace le da a una molécula la capacidad de sufrir rotación alrededor de ese enlace entre sí. Por lo tanto, esta rotación permite que una molécula tenga diferentes estructuras conformacionales. Además, este tipo de enlaces se forma con SP3 átomos hibridados de una molécula. Cuando dos iguales sp3 Las moléculas hibridadas se superponen linealmente, se forma un solo enlace.
¿Cuál es la diferencia entre el doble enlace y el enlace único??
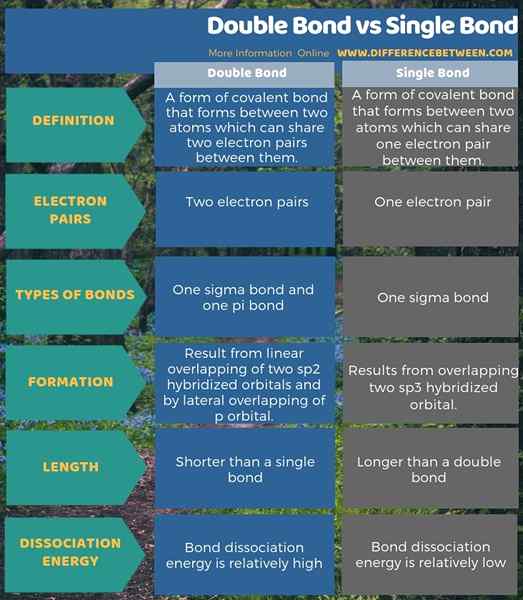
Los enlaces covalentes son principalmente de tres tipos; enlaces individuales, dobles enlaces y triples bonos. La diferencia clave entre el doble enlace y el enlace único es que, en una formación de un solo enlace, solo se comparte un par de electrones entre dos átomos, mientras que, en una formación de doble enlace, se comparten dos pares de electrones.
Además, una diferencia vital entre el doble enlace y el enlace único es que la unión única resulta de la superposición de dos orbitales hibridados SP3, mientras que los enlaces dobles resultan de la superposición lineal de dos orbitales hibridados SP2 y mediante la superposición lateral de P orbital P.
Además de eso, un solo enlace contiene un enlace Sigma, mientras que un doble enlace contiene un enlace Sigma y un enlace PI. Por lo tanto, esto afecta la longitud de la unión entre los átomos. Por lo tanto, lo que lleva a otra diferencia entre el doble enlace y el enlace único. Eso es; La longitud de un solo enlace es mayor que la de un doble enlace. Además, la energía de disociación de doble enlace es relativamente mayor que la energía de disociación de un solo enlace.
Resumen: doble enlace vs enlace único
Los enlaces dobles y los enlaces individuales son tipos de enlaces químicos covalentes. La diferencia clave entre el doble enlace y el enlace único es que, en una formación de un solo enlace, solo se comparte un par de electrones entre dos átomos, mientras que, en una formación de doble enlace, se comparten dos pares de electrones.
Referencia:
1. Helmenstine, Anne Marie, PH.D. “Definición y ejemplos de doble enlace en química."Thinkco, dec. 5, 2018. Disponible aquí
Imagen de cortesía:
1."Skeletal-Formulas-terminal-Double-Bond” (dominio público) a través de Commons Wikimedia
2."Metano-2D-cuadrado" (dominio público) a través de Commons Wikimedia


