Diferencia entre constante ebullioscópica y constante crioscópica
El diferencia clave entre constante ebullioscópico y constante crioscópica es que La constante ebullioscópica está relacionada con la elevación del punto de ebullición de una sustancia, mientras que la constante criocópica está relacionada con la depresión del punto de congelación de una sustancia.
Constante ebullioscópica y constante crioscópica son términos utilizados principalmente en termodinámica para describir las propiedades de una sustancia en relación con los cambios en la temperatura. Estas dos constantes dan el mismo valor para una sustancia particular en condiciones similares a través de diferentes rutas.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es la constante eBullioscópica?
3. ¿Qué es la constante crioscópica?
4. Comparación de lado a lado: constante ebullioscópica frente a constante crioscópica en forma tabular
5. Resumen
¿Qué es la constante eBullioscópica??
Una constante ebullioscópica es un término termodinámico que relaciona la molalidad de una sustancia con su elevación de punto de ebullición. Podemos denotar la constante ebullioscópica como KB, la elevación del punto de ebullición como ΔT y molalidad como "B". La constante se da como la relación entre la elevación del punto de ebullición y la molalidad (la elevación del punto de ebullición dividida por la molalidad es igual a la constante eBullioscópica, KB). Podemos dar la expresión matemática para esta constante como sigue:
ΔT = IKbb
En esta ecuación, "I" es el factor Van't Hoff. Da la cantidad de partículas que el soluto puede dividirse o se forma cuando la sustancia se disuelve en un solvente. "B" es la molalidad de la solución formada después de esta disolución. Además de esta ecuación simple, podemos usar otra expresión matemática para calcular la constante ebullioscópica teóricamente:
Kb = RT2bM/ ΔHVAP
En esta ecuación, R se refiere a la constante de gas ideal (o universal), la TB se refiere al punto de ebullición del disolvente, M se refiere a la masa molar del solvente y ΔHVAP se refiere a la entalpía molar de la vaporización. Sin embargo, en el cálculo de la masa molar de una sustancia, podemos usar un valor conocido para esta constante utilizando un procedimiento llamado ebullioscopy. EBullioscopy se refiere a la "medición de ebullición" en el significado latino.

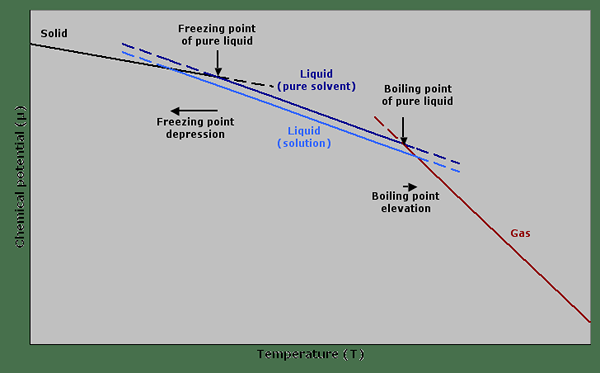
Figura 01: Depresión del punto de congelación y elevación del punto de ebullición en un gráfico
La propiedad de la elevación del punto de ebullición se considera una propiedad de coligeración donde la propiedad depende del número de partículas disueltas en el solvente y no de la naturaleza de esas partículas. Algunos valores conocidos para la constante ebullioscópica incluyen ácido acético que tiene 3.08, benceno tiene 2.53, alcanfor con 5.95, y el disulfuro de carbono tiene 2.34.
¿Qué es la constante crioscópica??
Una constante crioscópica es un término termodinámico que relaciona la molalidad de una sustancia con la depresión del punto de congelación. La depresión del punto de congelación también es una propiedad coligatoria de las sustancias. La constante crioscópica se puede administrar como se muestra a continuación:
ΔtF = IKFb
Aquí, "I" es el factor Van't Hoff, que es el número de partículas en las que el soluto puede dividirse o puede formarse cuando se disuelve en un solvente. La crioscopia es el proceso que podemos usar para determinar la constante crioscópica de una sustancia. Podemos usar una constante conocida para calcular una masa molar desconocida. El término crioscopia proviene del significado griego, "medición de congelación".
Dado que la depresión del punto de congelación es una propiedad de coligeración, depende solo del número de partículas de soluto que se disuelven y no de la naturaleza de esas partículas. Por lo tanto, podemos decir que la crioscopia está relacionada con la ebullioscopia. La expresión matemática para esta constante es la siguiente:
Kb = RT2FM/ ΔHfus
Donde r es la constante de gas ideal, M es la masa molar del solvente, tF es el punto de congelación del disolvente puro y ΔHfus es la entalpía molar de la fusión del solvente.
¿Cuál es la diferencia entre la constante ebullioscópica y la constante crioscópica??
Constante ebullioscópica y constante crioscópica son términos utilizados en termodinámica. La diferencia clave entre la constante ebullioscópica y la constante crioscópica es que la constante ebullioscópica está relacionada con la elevación del punto de ebullición de una sustancia, mientras que la constante crioscópica está relacionada con la depresión del punto de congelación de una sustancia.
A continuación, la infografía resume las diferencias entre constante ebullioscópica y constante crioscópica.

Resumen -Constante eBullioscópica vs constante crioscópica
La diferencia clave entre la constante ebullioscópica y la constante crioscópica es que la constante ebullioscópica está relacionada con la elevación del punto de ebullición de una sustancia, mientras que la constante crioscópica está relacionada con la depresión del punto de congelación de una sustancia.
Referencia:
1. "Constante crioscópica."Wikipedia, Fundación Wikimedia, 4 de febrero. 2020, disponible aquí.
Imagen de cortesía:
1. "Depresión del punto de congelación y elevación del punto de ebullición"- modificado Freezing_point_depresion_and_boiling_point_elevation.PNG de Tomas ER (CC BY-SA 3.0) a través de Commons Wikimedia


