Diferencia entre EDTA y EGTA
EDTA VS EGTA
EDTA y EGTA son agentes quelantes. Ambos son ácidos poliamino carboxílicos y tienen más o menos las mismas propiedades.
Edta
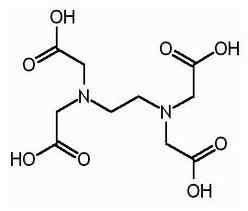
EDTA es el nombre acortado para el ácido tetraacético de etileno diamina. También se conoce como ácido tetraacético (etileno dinitrilo). La siguiente es la estructura de EDTA.

La molécula EDTA tiene seis sitios donde se puede atar un ion metálico. Hay dos grupos amino y cuatro grupos carboxilo. Los dos átomos de nitrógeno de grupos amino tienen un par de electrones no compartidos en cada uno. Edta es un ligando hexadentado. Además, es un agente quelante debido a la capacidad de secuestrar iones de metales. EDTA forma quelatos con todos los cationes, excepto los metales álcali y estos quelatos son lo suficientemente estables. La estabilidad resulta de los varios sitios de complejación dentro de la molécula que da lugar a una estructura similar a la jaula que rodea el ion metálico. Esto aísla el ion metálico de las moléculas de solvente, evitando así la solvatación. El grupo carboxilo de EDTA puede disociar los protones de donación; Por lo tanto, el EDTA tiene propiedades ácidas. Las diversas especies de EDTA se abrevian como h4Y, H3Y-, H2Y2-, Hy3- y y4-. A muy bajo pH (medio ácido), la forma protonada de EDTA (H4Y) es predominante. En contraste, a alto pH (medio básico), forma completamente desprotonada (y4-) predomina. Y a medida que el pH cambia de pH bajo a pH alto, otras formas de EDTA predominan en ciertos valores de pH. EDTA está disponible como forma totalmente protonada o de forma de sal. Disodium edta y calcio disodium edta son las formas de sal más comunes disponibles. El ácido libre h4Y y el dihidrato de la sal de sodio na2H2Y.2h2O están disponibles comercialmente en calidad de reactivos.
Cuando se disuelve en agua, el edta actúa como un aminoácido. Existe como un doble zwitterion. En esta ocasión, la carga neta es cero, y hay cuatro protones disociables (dos protones están asociados con los grupos carboxilo y dos asociados con los grupos aminos). EDTA se usa ampliamente como un titulador complejométrico. Las soluciones de EDTA son importantes como un titulador porque se combina con iones metálicos en una relación 1: 1 independientemente de la carga en el catión. EDTA también se usa como conservante para muestras biológicas. Las pequeñas cantidades de iones metálicos presentes en muestras biológicas, y los alimentos pueden catalizar la oxidación del aire de los compuestos presentes en las muestras. EDTA compleja herméticamente estos iones metálicos, evitando así que catalizen la oxidación del aire. Por eso se puede usar como conservante.
Egta
Egta es el término abreviado para el ácido tetraacético de etilenglicol.Es un agente quelante, y muy similar al EDTA. EGTA tiene una mayor afinidad por los iones de calcio que los iones de magnesio. EGTA tiene la siguiente estructura.
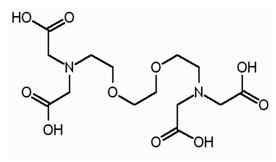
Similar a EDTA, EGTA también tiene cuatro grupos carboxilo, que pueden producir cuatro protones tras la disociación. Hay dos grupos aminos y los dos átomos de nitrógeno de grupos amino tienen un par de electrones no compartidos en cada uno. EGTA se puede usar como un tampón para parecerse al pH de una célula viva. Esta propiedad de EGTA permite su uso en la purificación de afinidad en tándem, que es una técnica de purificación de proteínas.
| Cuál es la diferencia entre EDTA y EGTA? • El EDTA es ácido tetraacético de etileno diamina y Egta es ácido tetraacético de etilenglicol. • EGTA tiene un peso molecular más alto que EDTA. • Además de los cuatro grupos carboxilo, dos grupos amino, EGTA también tiene otros dos átomos de oxígeno con electrones no compartidos. • EGTA tiene una mayor afinidad con los iones de calcio en comparación con EDTA. Y EDTA tiene una mayor afinidad con los iones de magnesio en comparación con EGTA. • EGTA tiene un punto de ebullición más alto que EDTA. |


