Diferencia entre la célula electroquímica y la célula galvánica
El diferencia clave entre la célula electroquímica y la célula galvánica es que La mayoría de las células electroquímicas tienden a convertir la energía eléctrica en energía química, mientras que las células galvánicas tienden a convertir la energía química en energía eléctrica.
Las reacciones de oxidación y reducción juegan un papel importante en la electroquímica. En una reacción de reducción de oxidación, los electrones se transfieren de un reactivo a otro. La sustancia que acepta electrones es el agente reductor, mientras que la sustancia que revela el electrón es el agente oxidante. El agente reductor es responsable de reducir el otro reactivo mientras se somete a la oxidación misma; Para el agente oxidante, este es viceversa. Estas reacciones ocurren en dos medias reacciones para mostrar oxidaciones y reducciones separadas; Por lo tanto, muestra el número de electrones entrando o fuera.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es una célula electroquímica?
3. ¿Qué es una célula galvánica?
4. Comparación de lado a lado: célula electroquímica frente a célula galvánica en forma tabular
5. Resumen
¿Qué es una célula electroquímica??
Una célula electroquímica es una combinación de un agente reductor y oxidante, que se separan físicamente entre sí. Por lo general, hacemos esta separación por un puente de sal. Aunque están físicamente separados, ambas medias células están en contacto químico entre sí. Las células electrolíticas y galvánicas son dos tipos de células electroquímicas.
Las reacciones de reducción de oxidación tienen lugar en las células electrolíticas y galvánicas. Por lo tanto, en una célula electroquímica, hay dos electrodos como ánodo y cátodo. Ambos electrodos se conectan externamente con un voltímetro de alta resistencia; Por lo tanto, la corriente no se transmite entre los electrodos. Por lo tanto, este voltímetro ayuda a mantener un cierto voltaje entre los electrodos donde tienen lugar las reacciones de oxidación.

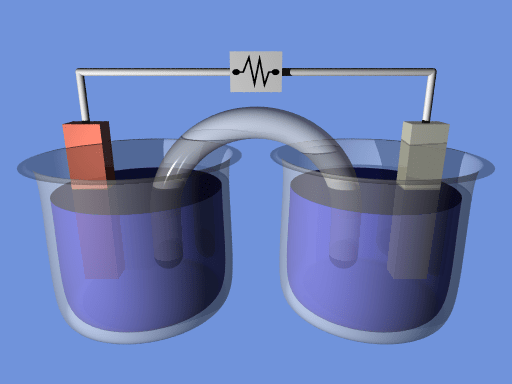
Figura 01: celda electroquímica
La reacción de oxidación tiene lugar en el ánodo, mientras que la reacción de reducción tiene lugar en el cátodo. Necesitamos sumergirlos en soluciones de electrolitos separados. Normalmente, estas soluciones son soluciones iónicas relacionadas con el tipo de electrodo. Por ejemplo, sumergimos electrodos de cobre en una solución de sulfato de cobre y electrodos de plata en una solución de cloruro de plata. Estas soluciones son diferentes; Por lo tanto, tienen que estar separados. La forma más común de separarlos es un puente de sal. En una célula electroquímica, la energía potencial de la célula se convierte en una corriente eléctrica, que podemos usar para encender una bombilla o hacer algún otro trabajo eléctrico.
¿Qué es una célula galvánica??
Las células galvánicas o voltaicas almacenan energía eléctrica. Las baterías están hechas de una serie de células galvánicas para producir un voltaje más alto. Las reacciones en los dos electrodos en las células galvánicas tienden a proceder espontáneamente. Cuando las reacciones tienen lugar, hay un flujo de electrones desde el ánodo hasta el cátodo a través de un conductor externo.
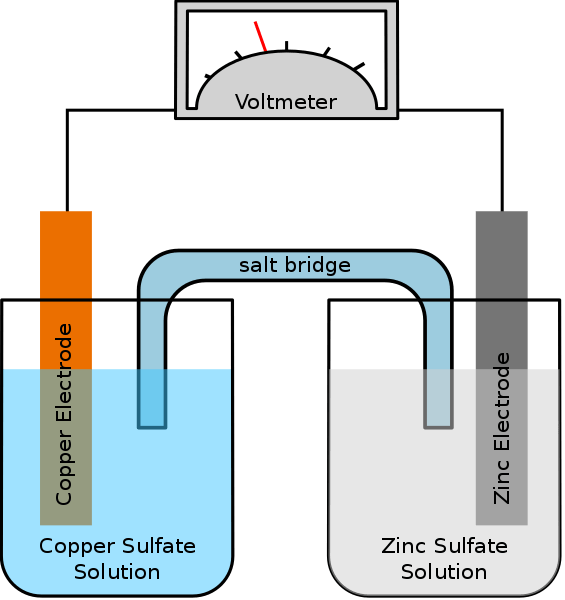
Figura 02: una célula galvánica
Por ejemplo, si los dos electrodos son plata y cobre en una célula galvánica, el electrodo de plata es positivo con respecto al electrodo de cobre. El electrodo de cobre es el ánodo, y sufre reacción de oxidación y libera electrones. Estos electrones van al cátodo de plata a través del circuito externo. Por lo tanto, el cátodo de plata sufre una reacción de reducción. Se genera una diferencia de potencial entre los dos electrodos, que permiten el flujo de electrones. La siguiente es la reacción celular espontánea de la célula galvánica anterior.
2 AG+ (aq) + cu (s) ⇌ 2ag (s) + cut2+ (aq)
¿Cuál es la diferencia entre la célula electroquímica y la célula galvánica??
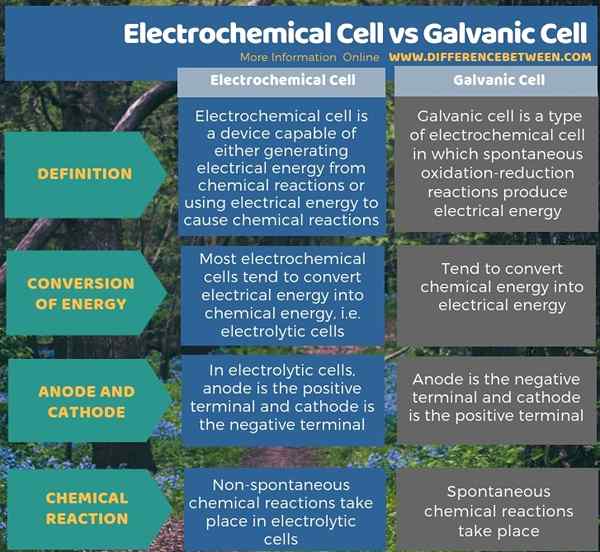
Hay dos tipos de células electroquímicas como células electrolíticas y células galvánicas. La diferencia clave entre la célula electroquímica y la célula galvánica es que la mayoría de las células electroquímicas tienden a convertir la energía eléctrica en energía química, mientras que las células galvánicas tienden a convertir la energía química en energía eléctrica. Además, en la mayoría de las células electroquímicas, como las células electrolíticas, el ánodo es el terminal positivo, mientras que el cátodo es el terminal negativo; Sin embargo, en la célula galvánica, el ánodo es el terminal negativo y el cátodo es el terminal positivo.
Además, una diferencia adicional entre la célula electroquímica y la célula galvánica es que en las células electroquímicas, como las células electrolíticas, tienen lugar las reacciones químicas no espontáneas, pero en las células galvánicas, tienen lugar las reacciones químicas espontáneas.
Resumen -Célula electroquímica y célula galvánica
Hay dos tipos de células electroquímicas como células electrolíticas y células galvánicas. La diferencia clave entre la célula electroquímica y la célula galvánica es que la mayoría de las células electroquímicas tienden a convertir la energía eléctrica en energía química, mientras que las células galvánicas tienden a convertir la energía química en energía eléctrica.
Referencia:
1."Célula electroquímica." Célula electroquímica: una descripción general | Temas de ciencias, Disponible aquí.
Imagen de cortesía:
1. "Electrochemcel" de Alksub en el inglés Wikipedia (CC By-SA 3.0) a través de Commons Wikimedia
2. "Galvanic Cell" de Gringer - Archivo: Galvanische Zelle.PNG, de Tinux (CC BY-SA 3.0) a través de Commons Wikimedia


