Diferencia entre electrolitos y no electrolitos
El diferencia clave entre electrolitos y no electrolitos es que Los electrolitos pueden producir iones cuando se disuelven en agua, mientras que los no electrolitos no pueden producir iones.
Podemos clasificar todos los compuestos en dos grupos como electrolitos y no electrolitos dependiendo de su capacidad para producir iones y realizar electricidad. El proceso de pasar una corriente a través de una solución electrolítica y forzar iones positivos y negativos para avanzar hacia sus respectivos electrodos se llama "electrólisis."Sin embargo, los no electrolitos no pueden participar en los procesos de electrólisis.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué son los electrolitos?
3. ¿Qué son los no electrolitos?
4. Comparación de lado a lado: electrolitos vs no electrolitos en forma tabular
5. Resumen
¿Qué son los electrolitos??
Los electrolitos son sustancias que producen iones. Estos compuestos pueden producir iones cuando están en la etapa fundida, o cuando se disuelven en un disolvente (agua). Debido a los iones, los electrolitos pueden realizar electricidad. También hay electrolitos de estado sólido. Además, algunos gases como el dióxido de carbono producen iones (iones de hidrógeno y bicarbonato) cuando se disuelve en agua.
Hay dos tipos de electrolitos: electrolitos fuertes y electrolitos débiles. Los electrolitos fuertes producen fácilmente iones cuando son solubles. Por ejemplo, los compuestos iónicos son electrolitos fuertes. El cloruro de sodio fundido o las soluciones de NaCl acuosa experimentan una disociación completa (en Na+y Cl-iones); Por lo tanto, son buenos conductores de electricidad. Los ácidos y las bases fuertes también son buenos electrolitos. Los electrolitos débiles producen pocos iones cuando son solubles en agua. Además, los ácidos débiles como el ácido acético y las bases débiles son electrolitos débiles.

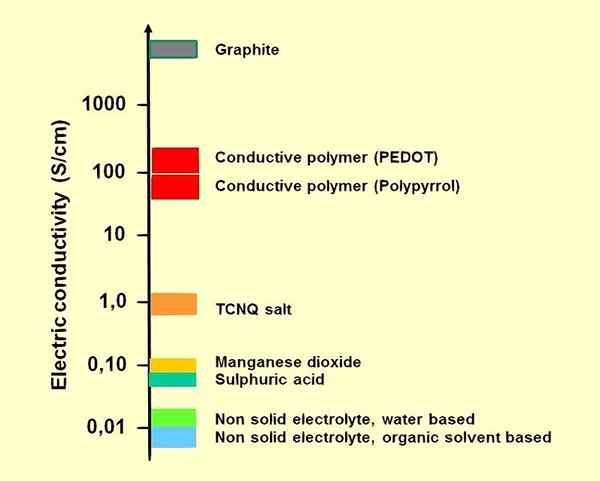
Figura 01: algunos electrolitos en comparación
Electrolitos en el cuerpo
Los electrolitos también están presentes en nuestro cuerpo. Necesitamos que mantengan el equilibrio dentro de las células y los fluidos sanguíneos en un cuerpo sano. El equilibrio electrolítico es crucial para mantener el equilibrio osmótico y la presión arterial dentro del cuerpo. N / A+, K+, y CA2+ son importantes en la transmisión del impulso nervioso y las contracciones musculares.
Varias hormonas en la homeostasis electrolítica de control del cuerpo. Por ejemplo, la aldosterona controla la cantidad de Na+. Las hormonas de calcitonina y paratormona juegan un papel para mantener la CA2+ y po43- balance. Podemos medir los niveles de electrolitos de la sangre para identificar ciertos desequilibrios electrolíticos. Sobre todo, na+ y k+ Los niveles en las mediciones de sangre y orina son importantes para verificar el mal funcionamiento del riñón. La NA normal+ El nivel en la sangre es 135 - 145 mmol/L, mientras que la K normal+ El nivel es 3.5 - 5.0 mmol/l. Los niveles extremos de electrolitos en el cuerpo pueden ser fatales. Los electrolitos también son importantes en los cuerpos vegetales. Por ejemplo, electrolitos (k+) Controle los mecanismos de apertura y cierre de estomas por celdas de protección.
¿Qué son los no electrolitos??
Los compuestos que no se dividen en iones positivos y negativos cuando los disolvimos en solventes no son electrolitos. La etapa fundida de estos compuestos tampoco genera iones. La ausencia de iones en el medio los hace no conductores. Principalmente, los compuestos con enlaces covalentes no polar/ compuestos orgánicos pertenecen a este grupo. Por ejemplo, sacarosa, glucosa, etano, etc.
¿Cuál es la diferencia entre electrolitos y no electrolitos??
La diferencia clave entre los electrolitos y los no electrolitos es que los electrolitos pueden producir iones cuando se disuelven en agua, mientras que los no electrolitos no pueden producir iones. Los compuestos iónicos y algunos compuestos con enlaces polares pueden ser electrolitos. Los compuestos con enlaces no polares son en su mayoría no electrolitos. Además, los electrolitos en las soluciones pueden llevar a cabo electricidad en contra de los no electrolitos.
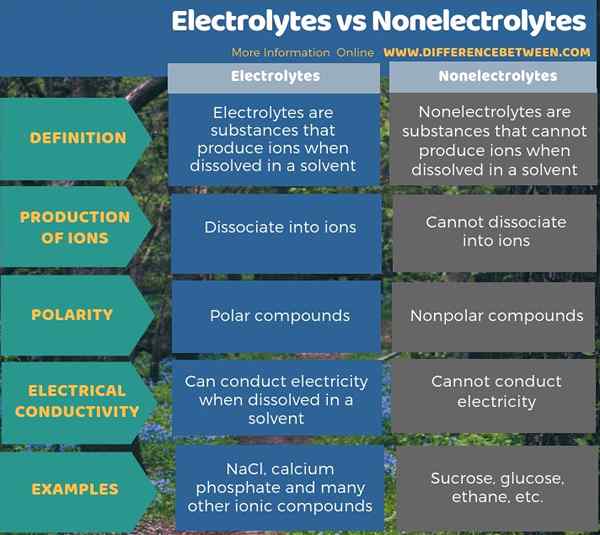
Resumen -Electrolitos vs no electrolitos
Todos los compuestos que conocemos son electrolitos o no electrolitos. La diferencia clave entre los electrolitos y los no electrolitos es que los electrolitos pueden producir iones cuando se disuelven en agua, pero los no electrolitos no pueden producir iones.
Referencia:
1. Helmenstine, Anne Marie. “Definición y ejemplos de electrolitos fuertes."Thinkco, Jul. 3, 2019, disponible aquí.
2. Helmenstine, Anne Marie. "Ejemplos de química: electrolitos fuertes y débiles."Thinkco, agosto. 6, 2019, disponible aquí.
Imagen de cortesía:
1. "Conductividad electrolitos -electric" por ELCAP - Trabajo propio (CC0) a través de Commons Wikimedia


