Diferencia entre la afinidad electrónica y la entalpía de ganancia de electrones
El diferencia clave entre la afinidad electrónica y la entalpía de ganancia de electrones es que La afinidad de los electrónicos se refiere a la tendencia de un átomo aislado a obtener un electrón, mientras que la entalpía de ganancia de electrones es la energía liberada cuando un átomo neutro aislado gana un electrón adicional.
La afinidad electrónica y la entalpía de ganancia de electrones son dos términos relacionados porque la entalpía de ganancia de electrones es una medida con respecto a la afinidad de los electrones.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es la afinidad electrónica?
3. ¿Qué es la entalpía de ganancia de electrones?
4. Comparación de lado a lado - Afinidad de electrones frente a la entalpía de ganancia de electrones en forma tabular
5. Resumen
¿Qué es la afinidad electrónica??
La afinidad electrónica es la cantidad de energía liberada cuando un átomo neutro o una molécula (en la fase gaseosa) gana un electrón desde el exterior. Este proceso de ganancia de electrones puede causar la formación de una especie química cargada negativamente.
Además, la adición de un electrón a un átomo neutro o una molécula libera energía. Podemos llamar a esto una reacción exotérmica. Este tipo de reacción da como resultado un ion negativo. Sin embargo, si se va a agregar otro electrón a este ion negativo, se debe administrar energía para continuar con esa reacción. Esto se debe a que el electrón entrante es repelido por otros electrones. Este fenómeno se llama reacción endotérmica.

Las primeras afinidades electrónicas son valores negativos y los segundos valores de afinidad de electrones de la misma especie son valores positivos.
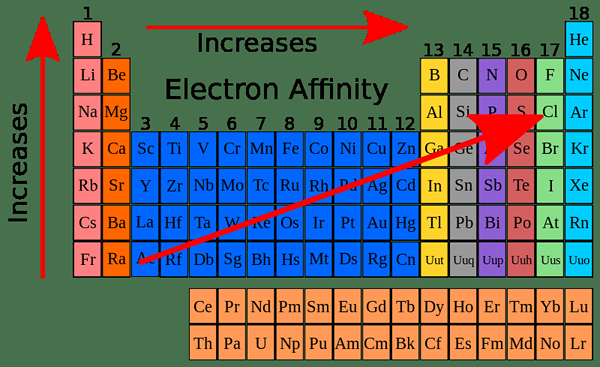
La afinidad electrónica muestra una variación periódica en la tabla periódica. Esto se debe a que el electrón entrante se agrega al orbital más externo de un átomo. Los elementos de la tabla periódica se organizan de acuerdo con el orden ascendente de su número atómico. Cuando aumenta el número atómico, aumenta el número de electrones que tienen en sus orbitales más externos.
En general, la afinidad electrónica debería aumentar a lo largo del período de izquierda a derecha porque el número de electrones aumenta a lo largo de un período; Por lo tanto, es difícil agregar un nuevo electrón. Cuando se analizan experimentalmente, los valores de afinidad electrónica muestran un patrón zig-zag en lugar de un patrón que muestra un aumento gradual.
¿Qué es la entalpía de ganancia de electrones??
La entalpía de ganancia de electrones es el cambio de entalpía cuando un átomo neutro o una molécula gana un electrón desde el exterior. Podemos decir que es la cantidad de energía liberada cuando un átomo o molécula neutra (en la fase gaseosa) gana un electrón desde el exterior. Por lo tanto, la entalpía de ganancia de electrones es otro término que usamos para la afinidad de los electrones. La unidad para la medición de la entalpía de ganancia de electrones es KJ/Mol. La nueva adición de electrones provoca la formación de una especie química cargada negativamente.
Sin embargo, existe una distinción entre la entalpía de ganancia de electrones y la afinidad de los electrones. La entalpía de ganancia de electrones representa la energía liberada al entorno cuando se obtiene un electrón, mientras que la afinidad de los electrones representa la energía absorbida por los alrededores cuando se gana un electrón cuando se gana un electrón cuando se gana un electrón cuando se obtiene. Por lo tanto, la entalpía de ganancia de electrones es un valor negativo, mientras que la afinidad electrónica es un valor positivo. Básicamente, ambos términos representan el mismo proceso químico.
La entalpía de ganancia de electrones nos da una idea sobre qué tan fuerte está un electrón en un átomo. Mayor la cantidad de energía liberada, mayor la entalpía de ganancia de electrones.
El valor de la entalpía de ganancia de electrones depende de la configuración de electrones del átomo al que se gana un electrón. La adición de un electrón a un átomo neutro o una molécula libera energía. Esto se llama reacción exotérmica. Esta reacción da como resultado un ion negativo. La entalpía de ganancia de electrones será un valor negativo. Pero si se va a agregar otro electrón a este ion negativo, se debe administrar energía para continuar con esa reacción. Esto se debe a que el electrón entrante es repelido por los otros electrones. Este fenómeno se llama reacción endotérmica. Aquí, la entalpía de ganancia de electrones será un valor positivo.
¿Cuál es la diferencia entre la afinidad electrónica y la entalpía de ganancia de electrones??
La afinidad electrónica es la cantidad de energía liberada cuando un átomo neutro o una molécula (en la fase gaseosa) gana un electrón desde el exterior. La entalpía de ganancia de electrones es el cambio de entalpía cuando un átomo neutro o una molécula gana un electrón desde el exterior. La diferencia clave entre la afinidad de los electrones y la entalpía de ganancia de electrones es que la afinidad de los electrones se refiere a la tendencia de un átomo aislado a obtener un electrón, mientras que la entalpía de ganancia de electrones es la energía que se libera cuando un átomo neutro aislado gana un electrones adicionales.
A continuación se muestra un resumen de la diferencia entre la afinidad electrónica y la entalpía de ganancia de electrones en forma tabular.
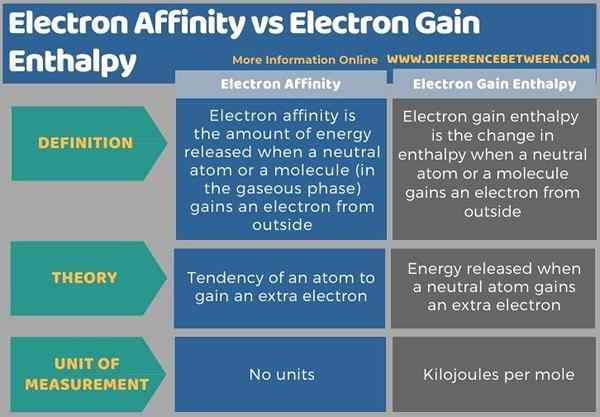
Resumen -Electron Affinity vs Electron Gane Entalpy
La afinidad electrónica y la entalpía de ganancia de electrones son dos términos relacionados porque la entalpía de ganancia de electrones es una medida con respecto a la afinidad de los electrones. La diferencia clave entre la afinidad de los electrones y la entalpía de ganancia de electrones es que la afinidad de los electrones se refiere a la tendencia de un átomo aislado a obtener un electrón, mientras que la entalpía de ganancia de electrones es la energía que se libera cuando un átomo neutro aislado gana un electrones adicionales.
Referencia:
1. "Afinidad electronica." Bibliotecas de química, Libretexts, 26 de septiembre. 2020, disponible aquí.
Imagen de cortesía:
1. "Tabla periódica de afinidad electrónica" de Cdang y Adrignola (CC BY-SA 3.0) a través de Commons Wikimedia


