Diferencia entre electronegatividad y energía de ionización
El diferencia clave entre la electronegatividad y la energía de ionización es que La electronegatividad explica la atracción de electrones, mientras que la energía de ionización se refiere a la eliminación de electrones de un átomo.
Los átomos son los bloques de construcción de todas las sustancias existentes. Son tan pequeños que ni siquiera podemos observarlos a nuestro simple hecho. Un átomo consiste en un núcleo, que tiene protones y neutrones. Además de los neutrones y los positrones, hay otras pequeñas partículas subatómicas en el núcleo, y hay electrones que rodean alrededor del núcleo en las orbitales. Debido a la presencia de protones, los núcleos atómicos tienen una carga positiva. Los electrones en la esfera externa tienen una carga negativa. Por lo tanto, las fuerzas atractivas entre las cargas positivas y negativas del átomo mantienen su estructura.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es la electronegatividad?
3. ¿Qué es la energía de ionización?
4. Comparación de lado a lado -ELECTRONEGATIVY VS Energía de ionización en forma tabular
5. Resumen
¿Qué es la electronegatividad??
La electronegatividad es la tendencia de un átomo a atraer los electrones en un enlace hacia él. En otras palabras, esto muestra la atracción de un átomo hacia los electrones. Comúnmente usamos la escala Pauling para indicar la electronegatividad de los elementos.
En la tabla periódica, la electronegatividad cambia de acuerdo con un patrón. De izquierda a derecha en un período, la electronegatividad aumenta, y de arriba a abajo en un grupo, la electronegatividad disminuye. Por lo tanto, el fluorine es el elemento más electronegativo con un valor de 4.0 en la escala Pauling. El grupo uno y dos elementos tienen menos electronegatividad; Por lo tanto, tienden a formar iones positivos dando electrones. Dado que el grupo 5, 6, 7 elementos tienen un valor de electronegatividad más alto, les gusta llevar electrones dentro y de iones negativos.
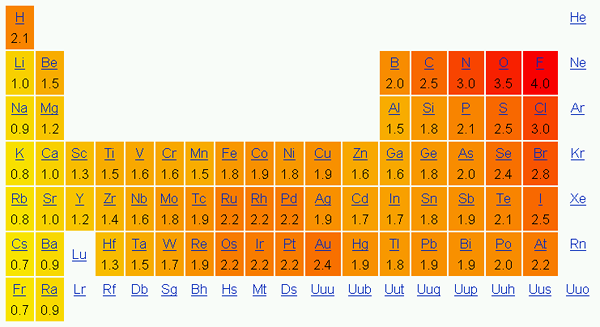
Figura 01: Electronegatividad de acuerdo con la escala Pauling
La electronegatividad también es importante para determinar la naturaleza de los enlaces. Si los dos átomos en el enlace no tienen diferencia de electronegatividad, entonces se formará un enlace covalente puro. Además, si la diferencia de electronegatividad entre los dos es alta, entonces un enlace iónico será el resultado. Si hay una ligera diferencia, se formará un enlace covalente polar.
¿Qué es la energía de ionización??
La energía de ionización es la energía que debe administrarse a un átomo neutro para eliminar un electrón de él. La eliminación de un electrón significa eliminar una distancia infinita de la especie para que no haya fuerzas de atracción entre el electrón y el núcleo (eliminación completa).
Podemos nombrar energías de ionización como primera energía de ionización, segunda energía de ionización, etc., dependiendo del número de electrones eliminados del átomo. Al mismo tiempo, esto dará lugar a cationes con cargos +1, +2, +3, etc.

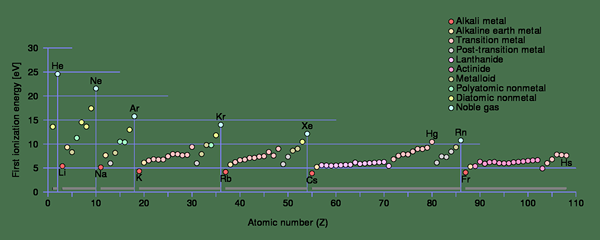
Figura 1: Tendencias de energía de ionización para la primera ionización en cada período de la tabla periódica
En átomos pequeños, el radio atómico es pequeño. Por lo tanto, las fuerzas de atracción electrostática entre el electrón y el neutrón son mucho más altas en comparación con un átomo con un radio atómico más grande. Aumenta la energía de ionización de un átomo pequeño. Si el electrón está más cerca del núcleo, la energía de ionización será mayor.
Además, las primeras energías de ionización de diferentes átomos también varían. Por ejemplo, la primera energía de ionización del sodio (496 kJ/mol) es mucho menor que la primera energía de ionización del cloro (1256 kJ/mol). Es porque al eliminar un electrón, el sodio puede obtener la configuración de gas noble; Por lo tanto, elimina fácilmente el electrón. Además, la distancia atómica es menor en sodio que en el cloro, lo que reduce la energía de ionización. Por lo tanto, la energía de ionización aumenta de izquierda a derecha en una fila y de abajo hacia arriba en una columna de la tabla periódica (este es el inverso del aumento del tamaño atómico en la tabla periódica). Al eliminar los electrones, hay algunos casos en los que los átomos obtienen configuraciones de electrones estables. En este punto, las energías de ionización tienden a saltar a un valor más alto.
Diferencia entre electronegatividad y energía de ionización?
La electronegatividad es la tendencia de un átomo a atraer los electrones en un enlace hacia él, mientras que la energía de ionización es la energía que un átomo neutro necesita para eliminar un electrón de él. Por lo tanto, la diferencia clave entre la electronegatividad y la energía de ionización es que la electronegatividad explica la atracción de electrones, mientras que la energía de ionización se refiere a la eliminación de electrones de un átomo.
Además, existe otra diferencia significativa entre la electronegatividad y la energía de ionización en función de sus tendencias en la tabla periódica de elementos. La electronegatividad aumenta de izquierda a derecha en un período y disminuye de arriba a abajo en un grupo. Mientras que la energía de ionización aumenta de izquierda a derecha en una fila y de abajo hacia arriba en una columna de la tabla periódica. Sin embargo, a veces, los átomos obtienen configuraciones de electrones estables y, por lo tanto, las energías de ionización tienden a saltar a un valor más alto.
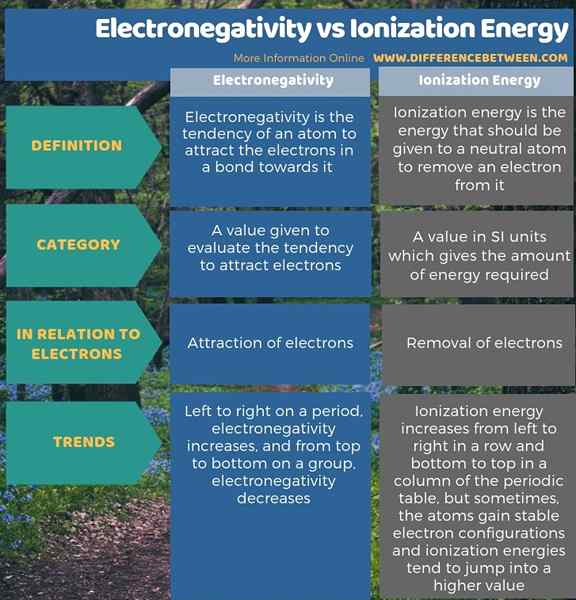
Resumen: electronegatividad frente a la energía de ionización
Los términos electronegatividad y energía de ionización explican las interacciones entre los núcleos atómicos y los electrones. La diferencia clave entre la electronegatividad y la energía de ionización es que la electronegatividad explica la atracción de electrones, mientras que la energía de ionización se refiere a la eliminación de electrones de un átomo.
Referencia:
1. Helmenstine, Anne Marie. “Definición y ejemplos de electronegatividad."Thinkco, octubre. 17, 2018, disponible aquí.
2. Helmenstine, Anne Marie. “Definición y tendencia de la energía de ionización."Thinkco, Jan. 24, 2019, disponible aquí.
Imagen de cortesía:
1. "Taula Periòdica Electronegativitat" de Joanjoc en Catalan Wikipedia - Transferido de CA.Wikipedia to Commons (dominio público) a través de Commons Wikimedia
2. "Primera energía de ionización" por Sponk (archivo PNG) GLRX (archivo SVG) Wylve (ZH-Hans, ZH-Hant) Palosirkka (FI) Michel Djerzinski (VI) Tferenczy (CZ) (SR-EC, SR-El, HR, HR , BS, sh) Depiep (Elementos 104-108) Bob Saint Clar (FR) Shizhao (Zh-Hans) Wiki Lic (ES) Agugg Karjono (ID) SZaszicska (Hu)-Trabajo propio basado en: Erste Ionisiergsenergie Pse Coded Coded.PNG por Sponk (CC por 3.0) a través de Commons Wikimedia


