Diferencia entre electronegatividad y polaridad
El diferencia clave entre la electronegatividad y la polaridad es que La electronegatividad es la tendencia de un átomo a atraer los electrones en un enlace hacia él, mientras que la polaridad significa la separación de las cargas.
La polaridad surge debido a las diferencias en la electronegatividad. Por lo tanto, estos dos términos son términos estrechamente relacionados. Sin embargo, existe una clara diferencia entre la electronegatividad y la polaridad. Una de esas diferencias entre electronegatividad y polaridad es que la electronegatividad describe las fuerzas de atracción a nivel atómico, mientras que la polaridad describe las fuerzas de atracción a nivel molecular.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es la electronegatividad?
3. Que es la polaridad
4. Comparación lado a lado: electronegatividad frente a polaridad en forma tabular
5. Resumen
¿Qué es la electronegatividad??
La electronegatividad es la tendencia de un átomo a atraer los electrones en un enlace hacia él. Básicamente, esto muestra la "semejanza" de un átomo hacia los electrones. Podemos usar la escala Pauling para indicar la electronegatividad de los elementos.
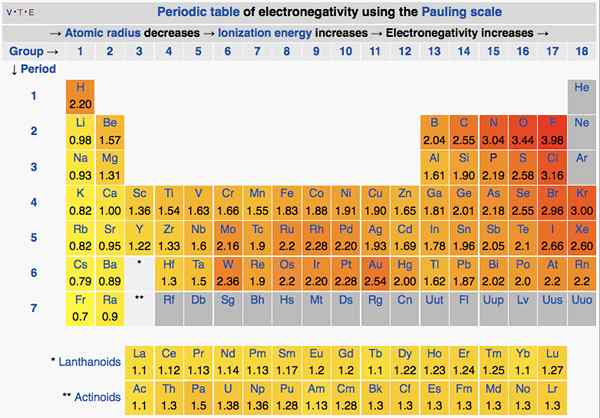
En la tabla periódica, la electronegatividad cambia de acuerdo con un patrón. De izquierda a derecha, en un período, la electronegatividad aumenta. De arriba a abajo, en un grupo, la electronegatividad disminuye. Por lo tanto, el fluorine es el elemento más electronegativo con un valor de 4.0 en la escala Pauling. El grupo uno y dos elementos tienen menos electronegatividad; Por lo tanto, tienden a formar iones positivos dando electrones. Dado que el grupo 5, 6, 7 elementos tienen un valor de electronegatividad más alto, les gusta llevar electrones dentro y de iones negativos.

Figura 01: Electronegatividad de elementos en la tabla periódica
La electronegatividad también es importante para determinar la naturaleza de los enlaces. Si los dos átomos en el enlace no tienen diferencia de electronegatividad, entonces se formará un enlace covalente. Si la diferencia de electronegatividad entre los dos es alta, entonces se formará un enlace iónico.
Que es la polaridad?
La polaridad surge debido a las diferencias en la electronegatividad de los átomos. Cuando dos del mismo átomo o átomos que tienen la misma electronegatividad forman un enlace entre ellos, estos átomos tiran del par de electrones de manera similar. Por lo tanto, tienden a compartir los electrones, y este tipo de enlaces no polares se conoce como enlaces covalentes. Sin embargo, cuando los dos átomos son diferentes, sus electronegatividades son a menudo diferentes. Pero el grado de diferencia puede ser mayor o menor. Por lo tanto, el par de electrones unidos se saca más por un átomo en comparación con el otro átomo que participa en la realización de la unión. Por lo tanto, dará como resultado una distribución desigual de electrones entre los dos átomos. Además, estos tipos de enlaces covalentes se conocen como enlaces polares.
Debido al intercambio desigual de electrones, un átomo tendrá una carga ligeramente negativa, mientras que el otro átomo tendrá una carga ligeramente positiva. En este caso, decimos que los átomos han obtenido una carga positiva negativa o parcial parcial. El átomo con una electronegatividad más alta obtiene la carga negativa parcial, y el átomo con la electronegatividad más baja obtendrá la carga positiva parcial. La polaridad se refiere a la separación de los cargos. Estas moléculas tienen un momento dipolo.
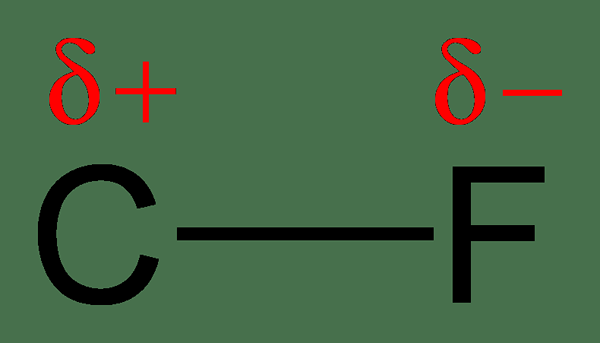
Figura 2: Separación de carga en un enlace C-F; El flúor es más electronegativo que el carbono
En una molécula, puede haber al menos un enlace o más. Algunos enlaces son polares, mientras que otros no son polares. Para que una molécula sea polar, todos los enlaces deben producir colectivamente una distribución de carga desigual dentro de la molécula.
Moléculas polares
Además, las moléculas tienen diferentes geometrías, por lo que la distribución de enlaces también determina la polaridad de la molécula. Por ejemplo, el cloruro de hidrógeno es una molécula polar con solo un enlace. La molécula de agua es una molécula polar con dos enlaces. El momento dipolar en estas moléculas es permanente porque han surgido debido a las diferencias de electronegatividad. Pero, hay otras moléculas que pueden ser polares solo en ciertas ocasiones. Una molécula con un dipolo permanente puede inducir un dipolo en otra molécula no polar, que también se convertirá en moléculas polares temporales. Incluso dentro de una molécula, ciertos cambios pueden causar un momento dipolar temporal.
¿Cuál es la diferencia entre electronegatividad y polaridad??
La electronegatividad es una medida de la tendencia de un átomo a atraer un par de electrones de unión, mientras que la polaridad es propiedad de tener polos o ser polares. Entonces, la diferencia clave entre la electronegatividad y la polaridad es que la electronegatividad es la tendencia de un átomo a atraer los electrones en un enlace hacia él, mientras que la polaridad es la separación de las cargas.
Además, una diferencia adicional entre la electronegatividad y la polaridad es que la electronegatividad describe las fuerzas de atracción a nivel atómico, mientras que la polaridad describe las fuerzas de atracción a nivel molecular. Por lo tanto, la atracción entre el núcleo atómico y los electrones más externos es la razón por la que un átomo tiene un valor de electronegatividad; Por lo tanto, determina el valor de la electronegatividad. Pero, la polaridad es causada por la separación de las cargas en un enlace debido a las diferencias en los valores de electronegatividad de los átomos.
A continuación, la infografía muestra más detalles sobre la diferencia entre electronegatividad y polaridad.
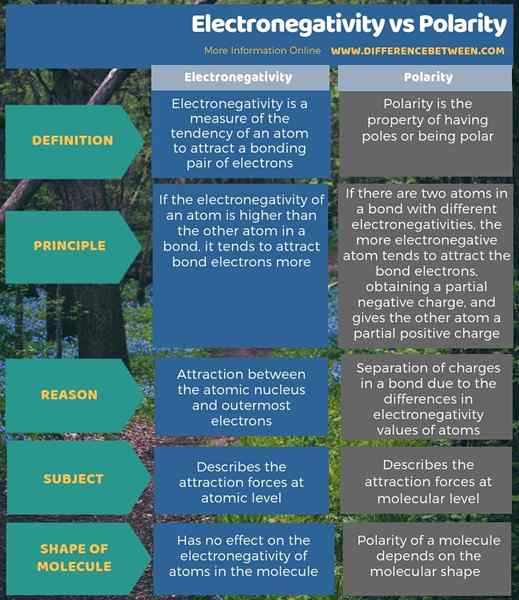
Resumen -Electronegatividad vs polaridad
La electronegatividad y la polaridad son términos relacionados; La electronegatividad de los átomos en una molécula determina la polaridad de la molécula. La diferencia clave entre la electronegatividad y la polaridad es que la electronegatividad es la tendencia de un átomo a atraer los electrones en un enlace hacia él, mientras que la polaridad significa la separación de las cargas.
Referencia:
1. Helmenstine, Anne Marie. “Definición y ejemplos de electronegatividad."Thinkco, octubre. 17, 2018, disponible aquí.
Imagen de cortesía:
1. "Tabla periódica Pauling ElectronegatVity" por DMacks - (CC BY -SA 3.0) a través de Commons Wikimedia
2. "Ben Mills-Wikimedia a través de Commons Wikimedia


