Diferencia entre efectos electrónicos y estéricos
El diferencia clave entre los efectos electrónicos y estéricos es que Los efectos electrónicos son las interacciones de unión, mientras que los efectos estéricos son interacciones sin fondos.
Los efectos electrónicos y estéricos son dos conceptos químicos diferentes que describen el efecto de las interacciones entre los electrones en una molécula en su estructura y propiedades. El efecto electrónico describe el efecto de los electrones que se encuentran en los enlaces químicos entre los átomos de la molécula, mientras que el efecto estérico describe el efecto de los electrones que no están involucrados en la unión química, sino que ocurren como pares de electrones solitarios o electrones no acogedores.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es un efecto electrónico?
3. ¿Cuál es el efecto estérico?
4. Comparación de lado a lado: efectos electrónicos vs estéricos en forma tabular
5. Resumen
¿Qué es un efecto electrónico??
El efecto electrónico es el efecto de la unión de los electrones de una molécula en su estructura y propiedades. Estos efectos influyen en la estructura, la reactividad y las propiedades de una molécula, pero estos no son enlaces o efectos estéricos tradicionales.

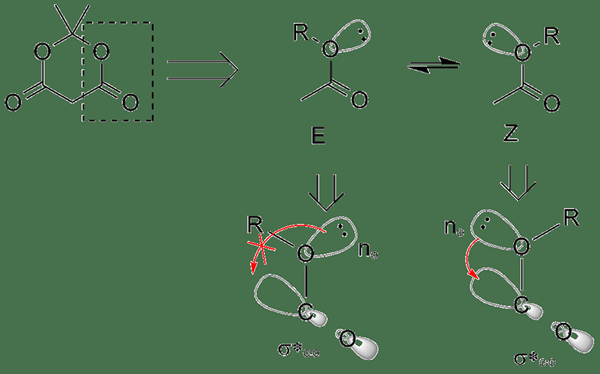
Figura 01: Efecto estereoelectrónico en los ésteres
Hay diferentes tipos de efectos electrónicos:
- Inducción: redistribución de la densidad de electrones a través de enlaces sigma tradicionales dependiendo de la electronegatividad de los átomos en una molécula
- Conjugación: redistribución de la densidad de electrones que se transmite a través de enlaces PI de interconexión
- Hiperconjugación: estabilización de interacciones entre electrones de un enlace sigma y orbital no acumulado adyacente o antibonding pi orbital
- Interacciones electrostáticas: fuerzas atractivas y repulsivas relacionadas con la acumulación de la carga eléctrica en la influencia trans de la molécula: la influencia de los enlaces de los complejos de coordinación en los ligandos trans a los enlaces (efecto de ligandos de complejos planos o octaédricos cuadrados en los ligandos)
¿Cuál es el efecto estérico??
Los efectos estéricos son los efectos de los electrones no acosados de una molécula en su estructura y propiedades. Este efecto influye en la conformación y la reactividad de iones y moléculas. Este tipo de efectos ocurre debido a las fuerzas repulsivas en la molécula, causadas por la superposición de las nubes de electrones.

Figura 2: Diferentes compuestos usan diferentes conformaciones para minimizar el obstáculo estérico
La principal consecuencia de este efecto es un obstáculo estérico. El obstáculo estérico se refiere a la desaceleración de las reacciones químicas debido a la mayor parte de los reactivos. Además, altera la forma de la molécula. El conocimiento de este concepto químico es muy importante en el campo de la química, la bioquímica y la farmacología.
¿Cuál es la diferencia entre efectos electrónicos y estéricos??
Los efectos electrónicos y estéricos son dos conceptos químicos diferentes que describen el efecto de las interacciones entre los electrones en una molécula en su estructura y propiedades. La diferencia clave entre los efectos electrónicos y estéricos es que los efectos electrónicos son las interacciones de unión, mientras que los efectos estéricos son interacciones no de filo.
Además, otra diferencia entre los efectos electrónicos y estéricos es que los efectos electrónicos influyen en la estructura, la reactividad y las propiedades de una molécula, mientras que el efecto estérico influye en la conformación y la reactividad.
Resumen -Efectos electrónicos vs estéricos
Los efectos electrónicos y estéricos son dos conceptos químicos diferentes que describen el efecto de las interacciones entre los electrones en una molécula en su estructura y propiedades. El efecto electrónico describe el efecto de los electrones que se encuentran en los enlaces químicos entre los átomos de la molécula, mientras que el efecto estérico describe el efecto de los electrones que no están involucrados en la unión química, sino que ocurren como pares de electrones solitarios o electrones no acogedores. Por lo tanto, la diferencia clave entre los efectos electrónicos y estéricos es que los efectos electrónicos son las interacciones de unión, mientras que los efectos estéricos son interacciones no que no tienen un enlace.
Referencia:
1. "Efecto electrónico."Wikipedia, Fundación Wikimedia, 26 de febrero. 2019, disponible aquí.
2. "Principios básicos en química orgánica: efectos estéricos y electrónicos en un vínculo covalente."Proyecto de enseñanza abierta, disponible aquí.
3. "Efectos estéricos."Wikipedia, Fundación Wikimedia, 14 de noviembre. 2019, disponible aquí.
Imagen de cortesía:
1. "Efecto estereoelectrónico de éster" por Arnomba - Trabajo propio (dominio público) a través de Commons Wikimedia
2. "Metilo Group Cyclohexane" de Emily - Trabajo propio (dominio público) a través de Commons Wikimedia


