Diferencia entre el efecto electroforético y asimétrico
El diferencia clave entre el efecto electroforético y asimétrico es que El efecto electroforético es el efecto de las fuerzas de atracción entre las especies iónicas y las moléculas de solvente sobre el movimiento de los iones, mientras que el efecto asimétrico es el efecto de la alta concentración de iones en la solución sobre el movimiento de iones.
Los términos efectos electroforéticos y el efecto asimétrico generalmente se discuten bajo el tema "conductividad electrolítica". La conductividad electrolítica describe el movimiento de especies iónicas (cationes y aniones) en una solución. Hay dos tipos principales de efectos que pueden hacer cambios en la conductividad iónica: efecto electroforético y efecto asimétrico.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es el efecto electroforético?
3. ¿Qué es el efecto asimétrico?
4. Comparación de lado a lado - Efecto asimétrico electroforético frente a
5. Resumen
¿Qué es el efecto electroforético??
El efecto electroforético es el efecto de las moléculas solventes sobre el movimiento de un ion particular en una solución. Es un factor importante que puede ralentizar el movimiento de los iones dentro de una solución. Debido a las fuerzas atractivas entre las moléculas solventes y las especies iónicas en la solución, cuando se aplica un potencial eléctrico en la solución, tiende a mover la atmósfera iónica alrededor de un ion en movimiento particular en sí mismo. Este ion en movimiento está en el centro de la atmósfera iónica. Debido a este efecto electroforético, el ion central está influenciado para moverse hacia el polo opuesto a su atmósfera iónica, lo que provoca el lento movimiento del ion.

Figura 01: una solución con un potencial eléctrico externo aplicado a él
¿Qué es el efecto asimétrico??
El efecto asimétrico es el efecto de otros iones sobre el movimiento de un ion particular en una solución. En otras palabras, esto significa que una solución que contiene una alta concentración iónica muestra cambios en el movimiento iónico de lo habitual. Cuando aplicamos un potencial eléctrico en una solución electrolítica, los iones positivos o los cationes en la solución se mueven hacia el electrodo negativo y los iones negativos o los aniones se mueven hacia el electrodo positivo. Si la concentración de la solución es alta, los iones negativos se acercan a los iones positivos. Luego hay una resistencia en la especie iónica, que afecta la velocidad del ion en movimiento. Llamamos a este efecto el efecto asimétrico. El nombre "asimétrico" se da ya que la esfera de iones alrededor del ion en movimiento no es simétrico debido a la alta concentración iónica.
En una solución iónica altamente concentrada, las fuerzas de atracción entre los iones positivos y negativos son grandes. Cuando se aplica un potencial eléctrico a un ion particular, la densidad de carga de las cargas opuestas en la parte posterior es mayor que las de la parte delantera. Por lo tanto, ralentiza el movimiento del ion. Esto sucede debido a la densidad de carga asimétrica en la solución electrolítica.
¿Cuál es la diferencia entre el efecto electroforético y asimétrico??
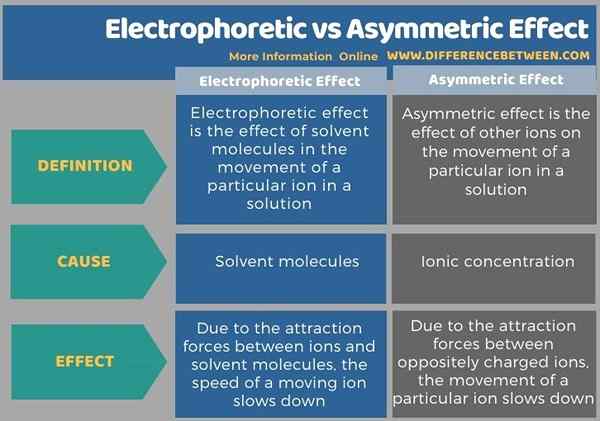
La conductividad electrolítica define el movimiento de las especies iónicas (cationes y aniones) en una solución. Hay dos tipos principales de efectos que pueden hacer cambios en la conductividad iónica: efecto electroforético y efecto asimétrico. La diferencia clave entre el efecto electroforético y asimétrico es que el efecto electroforético es el efecto de las fuerzas de atracción entre las especies iónicas y las moléculas de solvente sobre el movimiento de los iones, mientras que el efecto asimétrico es el efecto de la alta concentración de iones en la solución sobre el movimiento de los iones.
A continuación se muestra una tabulación resumida de la diferencia entre el efecto electroforético y asimétrico.
Resumen -efecto electroforético frente a asimétrico
Los términos efectos electroforéticos y el efecto asimétrico se discuten bajo el tema "conductividad electrolítica". La diferencia clave entre el efecto electroforético y asimétrico es que el efecto electroforético es el efecto de las fuerzas de atracción entre las especies iónicas y las moléculas de solvente sobre el movimiento de los iones, mientras que el efecto asimétrico es el efecto de la alta concentración de iones en la solución sobre el movimiento de los iones de.
Referencia:
1. “Ambiente iónico." Wikipedia, Fundación Wikimedia, 21 de octubre. 2019, disponible aquí.
Imagen de cortesía:
1. "Gelelektrophoreseparatur" (CC BY-SA 3.0) a través de Commons Wikimedia


