Diferencia entre electrovalencia y covalencia
El diferencia clave entre la electrovalencia y la covalencia es que el La electrovalencia es el número de electrones que un átomo gana o pérdidas en la formación de un ion, mientras que la covalencia es el número de electrones que un átomo puede compartir con otro átomo.
Aunque los términos electrovalía y covalencia suenan similares, son diferentes entre sí de acuerdo con sus definiciones. Principalmente, la electrovalencia explica la formación de un ion, mientras que la covalencia explica la formación de un enlace covalente.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es la electrovalencia?
3. ¿Qué es la covalencia?
4. Comparación de lado a lado: electrovalencia frente a covalencia en forma tabular
5. Resumen
¿Qué es la electrovalencia??
La electrovalencia es el número de electrones obtenidos o perdidos durante la formación de un ion de ese átomo. Por lo tanto, se refiere al número de electrones que un átomo gana o pérdidas al formar un enlace electrovalente, lo llamamos un enlace iónico. Según esta explicación, da la carga eléctrica neta sobre un ion. Además, si un átomo pierde electrones al formar un enlace iónico indica una electrovalencia positiva, mientras que si un átomo gana electrones al formar una unión iónica, indica que el átomo tiene una electrovalencia negativa. Los compuestos con átomos que tienen una electrovalencia son compuestos iónicos.

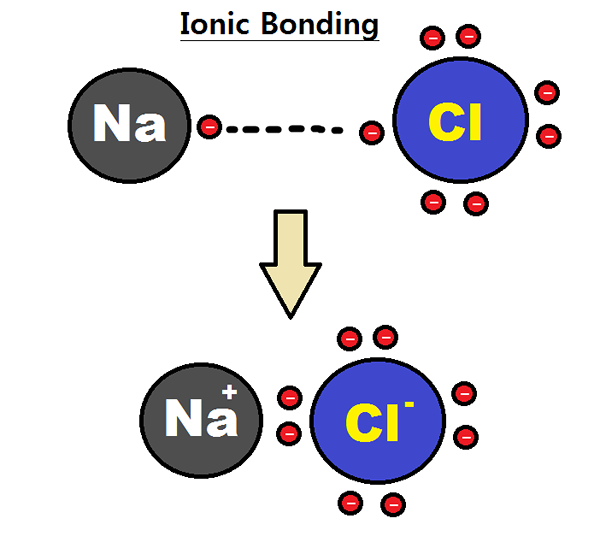
Figura 01: Formación de un enlace iónico
Por ejemplo, consideremos la formación de cloruro de sodio (NaCl). Allí, el átomo de sodio pierde un electrón; Por lo tanto, tiene una electrovalencia positiva. El átomo de cloro gana ese electrón. Por lo tanto, tiene una electrovalencia negativa. Sin embargo, dado que el número de electrones que se pierden o se ganan es uno, la electrovalencia de sodio (o cloro) es uno. Debemos dar la electrovalencia con el suspiro apropiado para indicar si se trata de una electrovalencia positiva o negativa.
- Sodio = electrovalencia positiva se puede administrar sodio como +1.
- Cloro = electrovalencia negativa del cloro se puede administrar como -1.
¿Qué es la covalencia??
La covalencia es el número máximo de electrones que puede compartir con otro átomo. Por lo tanto, indica el número máximo de enlaces covalentes que un átomo puede formar usando sus orbitales vacíos. El valor de este parámetro depende del número de electrones de valencia de un átomo y el número de orbitales vacíos presentes en un átomo.
Por ejemplo, un átomo de hidrógeno tiene solo un electrón; Por lo tanto, puede compartir un electrón con otro átomo. Por lo tanto, la covalencia de hidrógeno es 1. A diferencia de la electrovalencia, no necesitamos signos más o menos porque no hay pérdida o ganancia de electrones; Solo los electrones se comparten entre sí.
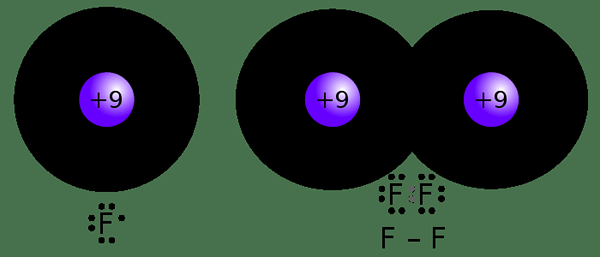
Figura 02: Formación de un enlace covalente
Como mencionamos anteriormente, no solo es importante el número de electrones de valencia sino también el número de orbitales vacíos de un átomo para determinar la covalencia. Por ejemplo, si consideramos el carbono como un ejemplo, tiene 4 electrones en la carcasa de electrones más externa. Allí, tiene los 2s22P2 configuración electronica. Por lo tanto, hay un orbital 2p vacío. Por lo tanto, los dos electrones emparejados en el orbital 2S pueden separarse, y un electrón se incluye en el orbital 2P vacío. Luego hay 4 electrones no apareados. El carbono puede compartir los cuatro electrones con otro átomo. Por lo tanto, la covalencia de convertirse en 4. Esto se debe a que cuando escribimos la configuración electrónica de carbono, vemos que solo hay 2 electrones no apareados, por lo que creemos que la covalencia del carbono es 2 cuando en realidad es 4.
¿Cuál es la diferencia entre electrovalencia y covalencia??
La electrovalencia es el número de electrones obtenidos o perdidos durante la formación de un ion de ese átomo. Explica la formación de un vínculo iónico. Además, los compuestos que tienen átomos con este parámetro son compuestos iónicos. La covalencia, por otro lado, es el número máximo de electrones que puede compartir con otro átomo. Explica la formación de un enlace covalente. Además, los compuestos que tienen átomos con covalencia son compuestos covalentes.
La siguiente infografía presenta la diferencia entre electrovalencia y covalencia en forma tabular.

Resumen: electrovalencia vs covalencia
Aunque los términos electrovalencia y covalencia suenan similares, tienen definiciones y características distintas. La diferencia entre la electrovalencia y la covalencia es que la electrovalencia es el número de electrones que un átomo gana o pérdidas en la formación de un ion, mientras que la covalencia es el número de electrones que un átomo puede compartir con otro átomo.
Referencia:
1. "2. Idea elemental de unión."Papel del pH en la química de la vida cotidiana. Disponible aquí
2. “Covalencia química y estructuras moleculares."Investigación de tiempo de tiempo de respuesta de biología. Disponible aquí
Imagen de cortesía:
1."Ionicbondingrh11" de Rhannosh - Trabajo propio, (CC By -SA 3.0) a través de Commons Wikimedia
2."Fluorine de enlace covalente" por Jacek FH - Trabajo propio, (CC BY -SA 3.0) a través de Commons Wikimedia


