Diferencia entre la unión electrovalente y covalente
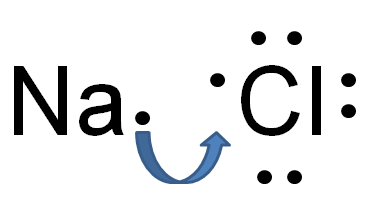
La diferencia clave entre el electrovalente y el enlace covalente es que El enlace electrovalente ocurre transfiriendo electrones de un átomo a otro mientras El enlace covalente ocurre como resultado de compartir electrones de valencia entre átomos. Una unión iónica también se llama unión electrovalente. Los electrones de valencia, que son electrones ubicados en las cubiertas más externas de un átomo, están involucrados en ambos tipos de enlaces químicos.
La unión química es la clave para formar varios tipos de compuestos químicos. Actúa como un pegamento para mantener átomos o moléculas juntas. El objetivo principal de la unión química es producir un compuesto químico estable. Cuando se forma un enlace químico, se libera energía, formando un compuesto estable. Hay tres tipos principales de enlaces químicos conocidos como enlace iónico, enlace covalente y enlaces metálicos o no covalentes.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es un enlace electrovalente?
3. ¿Qué es un enlace covalente?
4. Comparación de lado a lado: enlace electrovalente frente a covalente
5. Resumen
¿Qué es un enlace electrovalente??
El enlace electrovalente o iónico es un tipo de enlace químico que se forma como resultado de la transferencia de electrones de un átomo a otro. Esta transferencia hace que un átomo se cargue positivamente y el otro átomo se cargue negativamente. El átomo del donante de electrones se carga positivamente; Por lo tanto, se llama catión, mientras que el átomo de recepción de electrones se carga negativamente y se llama anión. Una atracción electrostática surge entre este catión y anión debido a cargas eléctricas opuestas. La gran diferencia en la electronegatividad entre los dos átomos hace que este enlace. Los átomos metálicos y no metálicos están involucrados en este vínculo.
Sin embargo, ninguno de los enlaces de electrovalente son enlaces iónicos puros. Todos y cada uno de los compuestos iónicos pueden tener algún porcentaje de unión covalente. Por lo tanto, revela que un compuesto iónico tiene un mayor carácter iónico y un bajo grado de carácter covalente. Pero hay algunos compuestos con un grado considerable de carácter covalente. Ese tipo de enlace se llama enlaces covalentes polares.
Las características de los compuestos que se construyen a partir de la unión de electrovalentes son diferentes de los compuestos construidos a partir de enlaces covalentes. Al considerar las propiedades físicas, se pueden observar puntos de ebullición típicamente más altos y puntos de fusión. Pero la solubilidad en el agua y la propiedad de conductividad eléctrica es considerablemente alta. Los ejemplos de compuestos con enlaces iónicos pueden incluir haluros de metales, óxidos de metales, sulfuros de metales, etc.
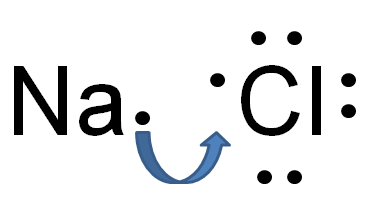
Figura 01: enlace electrovalente
¿Qué es un enlace covalente??
Un enlace covalente es un tipo de enlace químico que se forma como resultado de compartir pares de electrones entre átomos no metálicos. Este intercambio de electrones se produce debido a la baja diferencia de electronegatividad entre los dos átomos involucrados en la unión. En la unión covalente, los átomos no metálicos generalmente están involucrados. Estos átomos tienen una configuración de electrones incompleta en sus orbitales exteriores, por lo tanto, comparten electrones no apareados para lograr una configuración de electrones similar a un gas noble. Esto se debe a que la configuración de electrones incompleto hace que el átomo particular sea inestable. A diferencia de la unión iónica, la unión covalente puede tener enlaces únicos, dobles o triples enlaces entre dos átomos. Estos bonos se forman de tal manera que los dos átomos obedecen la regla del octeto. El enlace ocurre a través de la superposición de orbitales atómicos. Se forma un solo enlace cuando se comparten dos electrones. Se forma un doble enlace cuando se comparten cuatro electrones. Compartir seis electrones puede resultar en un triple enlace.
Las características de los compuestos con enlaces covalentes incluyen una fuerte unión entre dos átomos debido a valores de electronegatividad similares. Por lo tanto, la solubilidad y la conductividad eléctrica (en estado soluble) son pobres o ausentes. Estos compuestos también tienen puntos de fusión más bajos y puntos de ebullición en comparación con los compuestos iónicos. Se pueden tomar varios compuestos orgánicos e inorgánicos como ejemplos de compuestos con unión covalente.
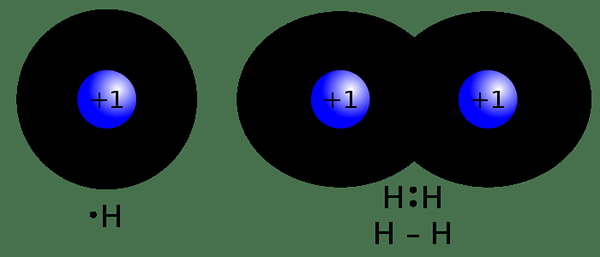
Figura 02: enlace covalente
¿Cuál es la diferencia entre la unión de electrovelo y la unión covalente??
Enlace electrovalente frente a enlace covalente | |
| El enlace electrovelante es un enlace químico entre dos átomos debido a una transferencia de electrones de un átomo a otro. | El enlace covalente es un tipo de enlace químico que ocurre debido al intercambio de pares de electrones entre átomos. |
| Metales vs no metales | |
| Se pueden observar enlaces electrovestres entre metales y no metales. | Los enlaces covalentes se pueden observar típicamente entre dos no metales. |
| Diferencia en la electronegatividad | |
| La diferencia en la electronegatividad entre dos átomos es mayor en la unión de electrovalentes. | La diferencia en la electronegatividad entre dos átomos es relativamente menor. |
| Solubilidad en agua y conductividad eléctrica | |
| La solubilidad en el agua y la conductividad eléctrica es mayor en compuestos con unión de electrovalentes. | La solubilidad en el agua y la conductividad eléctrica es relativamente menor en compuestos con enlaces covalentes. |
| Puntos de ebullición y fusión | |
| Los puntos de ebullición y fusión son más altos para la unión de electrovalentes. | Los puntos de ebullición y fusión son relativamente más bajos para la unión covalente. |
Resumen: electrovalentes versus enlaces covalentes
Los enlaces electrovestres y covalentes son dos tipos de enlaces químicos que son diferentes entre sí. La principal diferencia entre los enlaces electrovalentes y covalentes es su naturaleza; El enlace electrovalente es un tipo de atracción electrostática entre dos átomos, mientras que el enlace covalente está compartiendo pares de electrones entre dos átomos.
Referencia:
1. "Enjugar con electrovalización."EMEDICALPREP. norte.pag., norte.d. Web. 25 de mayo de 2017.<>
2."El enlace covalente ."Grupos de división de educación química. Universidad de Purdue, N.d. Web. 25 de mayo de 2017.<>
3."Enlaces químicos."Khan Academy, N.d. Web. 25 de mayo de 2017. <>
Imagen de cortesía:
1. "Bono iónico NaCl" por Mhowison - Trabajo propio (dominio público) a través de Commons Wikimedia
2. "Hidrógeno de enlace covalente" de Jacek FH - Trabajo propio (CC BY -SA 3.0) a través de Commons Wikimedia


