Diferencia entre fórmulas empíricas y moleculares
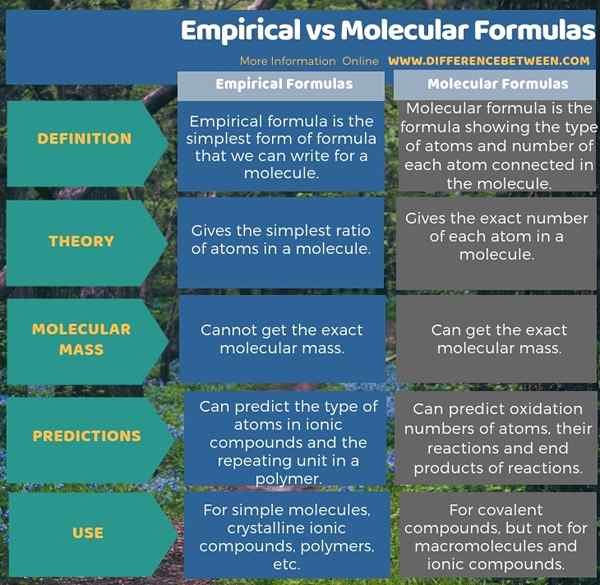
El diferencia clave entre las fórmulas empíricas y moleculares es que un La fórmula empírica solo da la relación más simple de átomos, mientras que una fórmula molecular da el número exacto de cada átomo en una molécula.
En química, a menudo usamos símbolos para identificar elementos y moléculas. La fórmula molecular y la fórmula empírica son dos métodos simbólicos que usamos para representar moléculas y compuestos de una manera fácil.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué son las fórmulas empíricas?
3. ¿Qué son las fórmulas moleculares?
4. Comparación de lado a lado - Fórmulas empíricas vs moleculares en forma tabular
5. Resumen
¿Qué son las fórmulas empíricas??
Las fórmulas empíricas son la forma más simple de fórmulas que podemos escribir para una molécula. Muestra el tipo de átomos en la molécula, pero no da el número real de cada átomo. Más bien, proporciona la relación entera más simple de cada átomo de la molécula.
Por ejemplo, C6H12O6 es la fórmula molecular de glucosa y ch2O es su fórmula empírica. Principalmente, damos fórmulas empíricas para compuestos iónicos, que están en forma cristalina. Por ejemplo, no podemos decir el número exacto de NA y CL en un cristal NaCl. Así que solo escribimos la fórmula empírica que denota la relación de átomos conectados.
Video 01: Fórmula empírica
Además, CA3(CORREOS4)2 es también una fórmula empírica. En un compuesto iónico, podemos escribir fácilmente la fórmula intercambiando las cargas de cada ion, y eso da automáticamente el número de cada ion en la molécula. Además, podemos escribir fórmulas empíricas para macromoléculas. Al escribir fórmulas empíricas para polímeros, escribimos la unidad repetida, y luego usamos la letra "n" para decir que puede haber un número de unidades repetidas en el polímero. Sin embargo, no podemos usar la fórmula empírica para encontrar la masa, la estructura o los isómeros de una molécula, pero es útil para fines analíticos.
¿Qué son las fórmulas moleculares??
Las fórmulas moleculares son las fórmulas que muestran el tipo de átomos y el número de cada átomo conectado en la molécula. Por lo tanto, da la estequiometría correcta de cada átomo. Los átomos se representan por sus símbolos, que se muestran en la tabla periódica. Además, debemos escribir los números de átomos como subíndices. Algunas fórmulas moleculares son neutrales (sin carga), pero si hay una carga, podemos mostrarla en el lado derecho como superíndice.
Normalmente usamos la fórmula molecular en las reacciones químicas, o al documentar cualquier detalle químico. Simplemente mirando la fórmula molecular, podemos obtener mucha información sobre la molécula. Por ejemplo, podemos calcular la masa molecular. Además, si se trata de un compuesto iónico, podemos predecir cuáles son los iones y cuántos de ellos se liberarán cuando se disuelva en agua.
Video 02: Comparación de fórmulas moleculares y empíricas
Además, podemos predecir los números de oxidación de cada átomo, cómo van a reaccionar en una reacción y los productos resultantes utilizando fórmulas moleculares. Sin embargo, solo de la fórmula molecular, no podemos predecir la disposición molecular exacta. Porque a veces hay varias fórmulas estructurales para una sola fórmula molecular. Estos son los "isómeros". Los isómeros tienen la misma fórmula molecular pero pueden diferir de la conectividad de los átomos (isómeros constitucionales) o la disposición espacial de los átomos (estéreo). Entonces, al mirar la fórmula molecular, podemos escribir todos los isómeros posibles para una molécula.
¿Cuál es la diferencia entre fórmulas empíricas y moleculares??
Las fórmulas empíricas son la forma más simple de fórmulas que podemos escribir para una molécula, mientras que las fórmulas moleculares son las fórmulas que muestran el tipo de átomos y el número de cada átomo conectado en la molécula. Por lo tanto, la diferencia clave entre las fórmulas empíricas y moleculares es que la fórmula empírica solo da la relación más simple de átomo, mientras que la fórmula molecular da el número exacto de cada átomo en una molécula en una molécula. Además, no podemos calcular la masa molecular exacta utilizando la fórmula empírica, mientras que podemos obtener la masa molecular exacta usando la fórmula molecular.
Como otra diferencia importante entre las fórmulas empíricas y moleculares, podemos decir que podemos predecir el tipo de átomos en los compuestos iónicos y la unidad de repetición en un polímero, mientras que podemos predecir los números de oxidación de cada átomo, cómo van a reaccionar en una reacción en una reacción , y los productos resultantes utilizando fórmulas moleculares.

Resumen -Fórmulas empíricas vs moleculares
Para una determinada molécula o una macromolécula, podemos escribir una fórmula empírica. Sin embargo, la fórmula molecular es la forma más detallada. La diferencia clave entre las fórmulas empíricas y moleculares es que una fórmula empírica solo da la relación más simple de átomo, mientras que una fórmula molecular da el número exacto de cada átomo en una molécula.
Referencia:
1. "Fórmula empírica 2." Metales de transición. Disponible aquí
2. Bibliotecas. "6.9: Calcular fórmulas moleculares para compuestos."Bibliotecas de química, National Science Foundation, 20 de mayo de 2018. Disponible aquí
Video cortesía:
1."75649220" por Elearn.Punjab a través de Vimeo
2."34647886" por Dick Trent a través de Vimeo


