Diferencia entre endergónico y exergónico
El diferencia clave Entre Endergonic y Exergonic es que Las reacciones endergónicas no son espontáneas y desfavorables, mientras que las reacciones exergónicas son espontáneas y favorables.
La energía es la capacidad de trabajar. En un sistema, la energía puede funcionar y la energía se puede cambiar a otras formas, como calor, sonido, luz, etc. Cuando la energía de un sistema cambia como resultado de una diferencia de temperatura entre el sistema y los alrededores, decimos que la energía se ha transferido como calor. Una reacción química puede considerarse como un sistema. Una reacción química es un proceso en el que uno o más compuestos se convierten en un nuevo conjunto de compuestos a través de una serie de cambios.
Cuando avanza la reacción, puede haber una transferencia de energía del circundante al sistema o viceversa. Algunas de estas reacciones son espontáneas, y otras no son. Todas las reacciones que ocurren en el medio ambiente no son espontáneas, pero vemos que estas reacciones no espontáneas tienen lugar naturalmente. Esto se debe a que las reacciones no espontáneas se combinan con las reacciones espontáneas y son impulsadas por la energía de las reacciones espontáneas.
CONTENIDO
1. Descripción general y diferencia de claves
2. Que es endergónico
3. Que es el exergónico
4. Comparación de lado a lado - Endergonic vs Exergonic en forma tabular
5. Resumen
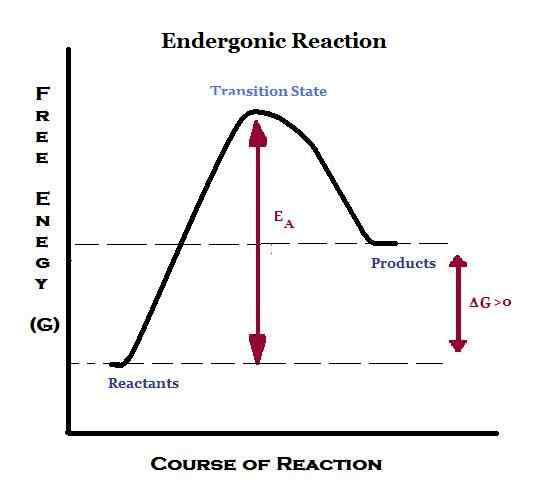
Que es endergónico?
La palabra "ender" se deriva de la palabra "endo" que significa "dentro". Por lo tanto, endergónico significa absorber energía en forma de trabajo. Por lo tanto, en una reacción endergónica, el circundante suministra energía al sistema. Además, los productos tendrán mayor energía que los reactivos. Se considera una reacción endergónica. Si esta transferencia de energía se lleva a cabo a presión y temperatura constantes, la energía libre de Gibbs estándar será positiva. Por lo tanto, la constante de equilibrio para una reacción endergónica es menor que una.

La fotosíntesis es una reacción endergónica que toma lugar en el entorno natural. Para la fotosíntesis, la energía es suministrada por la luz del sol. En el cuerpo humano, cuando se producen reacciones endergónicas, la energía es suministrada por el ATP. Por lo tanto, las reacciones endergónicas se combinan con reacciones de hidrólisis de ATP.
Que es el exergónico?
Exergónico significa liberar energía en forma de trabajo. En estas reacciones, la energía se libera del sistema al exterior. Las reacciones exergónicas son favorables y espontáneas.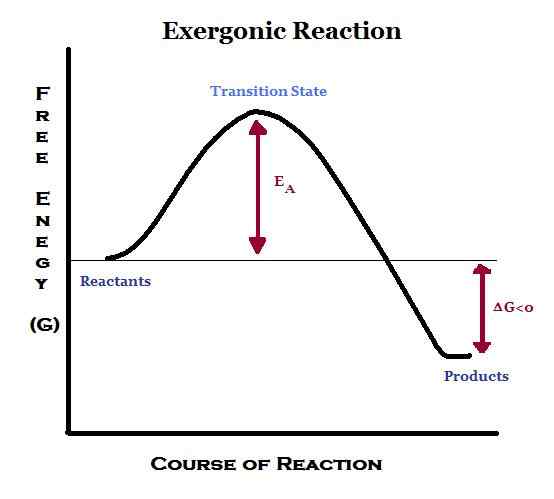
Dado que la energía se libera durante la reacción, los productos contienen menos energía que los reactivos. Por lo tanto, el cambio de entalpía (∆H) se vuelve negativo. Además, si la transferencia se lleva a cabo a presión y temperatura constantes, la energía libre de Gibbs estándar será un valor negativo.
¿Cuál es la diferencia entre endergónico y exergónico??
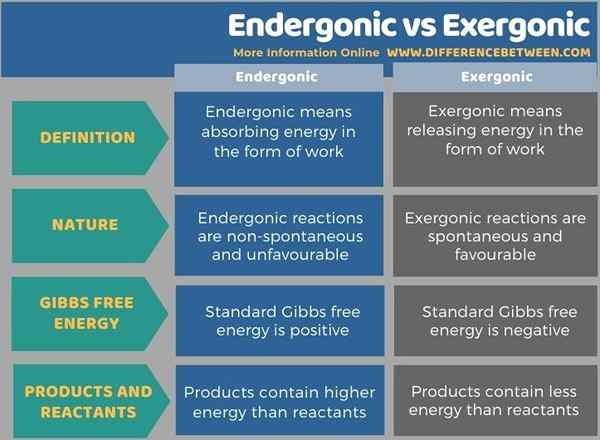
Endergónico significa absorber energía en forma de trabajo, mientras que el exergónico significa liberar energía en forma de trabajo. La diferencia clave entre endergónica y exergónica es que las reacciones endergónicas son no espontáneas y desfavorables, mientras que las reacciones exergónicas son espontáneas y favorables. La energía libre de Gibbs estándar será positiva en las reacciones endergónicas, en contraste con las reacciones exergónicas. En las reacciones exergónicas, los productos contienen menos energía que los reactivos pero, en las reacciones endergónicas, los productos contienen mayor energía que los reactivos.
Resumen -Endergonic vs Exergonic
Endergónico significa absorber energía en forma de trabajo, mientras que el exergónico significa liberar energía en forma de trabajo. La diferencia clave entre endergónica y exergónica es que las reacciones endergónicas son no espontáneas y desfavorables, mientras que las reacciones exergónicas son espontáneas y favorables.
Imagen de cortesía:
1. "Endergonic" de J3hoang - Trabajo propio (CC By -SA 3.0) a través de Commons Wikimedia
2. "Exergonic" de J3hoang - Trabajo propio (CC By -SA 3.0) a través de Commons Wikimedia


