Diferencia entre el punto final y el punto estequiométrico
El diferencia clave entre el punto final y el punto estequiométrico es que El punto final llega justo después del punto estequiométrico, mientras que el punto estequiométrico es el punto más preciso en el que se completa la neutralización.
Una titulación ácida-base implica una reacción de neutralización, que ocurre en el punto donde reacciona un ácido con una cantidad químicamente igual de base. Sin embargo, hay una ligera diferencia entre el punto teórico donde la reacción termina exactamente y el punto donde la detectamos prácticamente. Además, también debe tener en cuenta que el término punto de equivalencia es un nombre más utilizado para el punto estequiométrico.
CONTENIDO
1. Descripción general y diferencia de claves
2. Que es el punto final
3. ¿Qué es el punto estequiométrico?
4. Comparación lado a lado - punto final vs punto estequiométrico en forma tabular
5. Resumen
Que es el punto final?
El punto en el que parece completarse una reacción es el punto final de la titulación. Podemos determinar experimentalmente este punto. Consideremos un ejemplo para comprender prácticamente esto. Suponga que valoramos 100 ml de 0.1 M ácido clorhídrico (HCL) con 0.5 m hidróxido de sodio.
HCL(aq) + Naóbra(aq) ⟶ H2O + NaCl(aq)
Mantenemos el ácido en el matraz de titulación y la titulación de la NaOH en presencia de naranja metílica como indicador. En medio ácido, el indicador es incoloro y muestra un color rosa en el medio básico. Inicialmente, solo hay ácido (HCL 0.1 m/100 ml) en el matraz de titulación; El pH de la solución es igual a 2. A medida que agregamos NaOH, el pH de la solución aumenta debido a la neutralización de cierta cantidad de ácido en el medio. Tenemos que agregar la base continuamente de gota hasta que llegue a la finalización. El pH de la reacción se vuelve igual a 7 cuando la reacción está completa. Incluso en este punto, el indicador no muestra color en el medio, ya que cambia el color en el medio básico.
Para observar el cambio de color, necesitamos agregar una gota más de NaOH, incluso después de completar la neutralización. El pH de la solución cambia drásticamente en este punto. Este es el punto donde observamos a medida que se completa la reacción.
¿Qué es el punto estequiométrico??
El punto de equivalencia es el nombre común para el punto estequiométrico. Es el punto en el que el ácido o la base completa su reacción de neutralización. Una reacción se completa teóricamente en este punto, pero prácticamente no podemos observar el punto exacto. Es mejor si podemos determinar cuándo se alcanza el punto equivalente porque es el punto exacto donde ha tenido lugar la neutralización. Sin embargo, podemos observar la finalización de la reacción en el punto final.

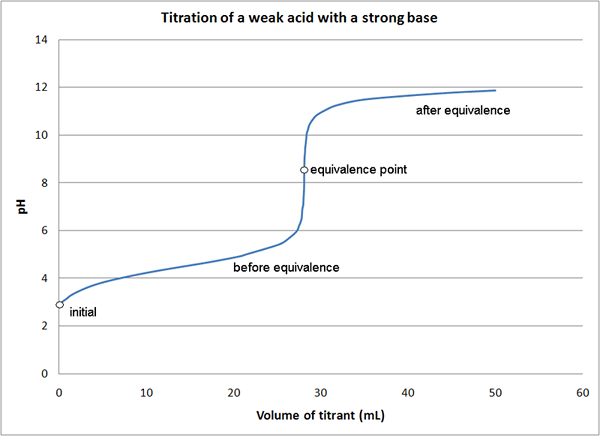
Figura 01: Gráfico para una titulación que muestra el punto de equivalencia
Si consideramos el mismo ejemplo que el anterior, al comienzo de la reacción, solo tenemos el ácido en el medio (HCl). Antes de alcanzar el punto de equivalencia, con la adición de NaOH, hemos ácido sin reaccionar y hemos formado una sal (HCl y NaCl). En el punto de equivalencia, solo tenemos sal en el medio. En el punto final, tenemos sal y la base (NaCl y NaAH) en el medio.
¿Cuál es la diferencia entre el punto final y el punto estequiométrico??
Punto final y punto estequiométrico (en común, punto de equivalencia) siempre son diferentes entre sí. La diferencia clave entre el punto final y el punto estequiométrico es que el punto final se produce justo después del punto estequiométrico, mientras que el punto estequiométrico es el punto más preciso en el que se completa la neutralización. Además, podemos observar el punto final pero no podemos observar el punto estequiométrico prácticamente.

Resumen -punto final vs punto estequiométrico
Punto final y punto estequiométrico (en común, punto de equivalencia) siempre son diferentes entre sí. La diferencia clave entre el punto final y el punto estequiométrico es que el punto final se produce justo después del punto estequiométrico, mientras que el punto estequiométrico es el punto más preciso en el que se completa la neutralización.
Referencia:
1. Helmenstine, Anne Marie. "Definición de punto de equivalencia."Thoughtco, puede. 7, 2019, disponible aquí.
Imagen de cortesía:
1."Titulación de ácido débil con una base fuerte" por Quantumkinetics - Trabajo propio (CC por 3.0) a través de Commons Wikimedia


