Diferencia entre la entalpía y la entropía
El diferencia clave Entre la entalpía y la entropía es que La entalpía es la transferencia de calor que tiene lugar en una presión constante, mientras que la entropía da una idea de la aleatoriedad de un sistema.
Para los fines de estudio en química, dividimos el universo en dos como sistema y sus alrededores. En cualquier momento, la parte que vamos a estudiar es el sistema, y el resto está rodeando. La entalpía y la entropía son dos términos que describen las reacciones que tienen lugar en un sistema y los alrededores. Tanto la entalpía como la entropía son funciones del estado termodinámico.
CONTENIDO
1. Descripción general y diferencia de claves
2. Que es la entalpía
3. Que es la entropía
4. Comparación lado a lado: entalpía vs entropía en forma tabular
5. Resumen
Que es la entalpía?
Cuando tiene lugar una reacción, puede absorber o evolucionar el calor, y si realizamos la reacción a presión constante, lo llamamos la entalpía de la reacción. Sin embargo, no podemos medir la entalpía de las moléculas. Por lo tanto, necesitamos medir el cambio de entalpía durante una reacción. Podemos obtener el cambio de entalpía (∆H) para una reacción en una temperatura y presión determinadas restando la entalpía de los reactivos de la entalpía de los productos. Si este valor es negativo, entonces la reacción es exotérmica. Si el valor es positivo, entonces la reacción es endotérmica.

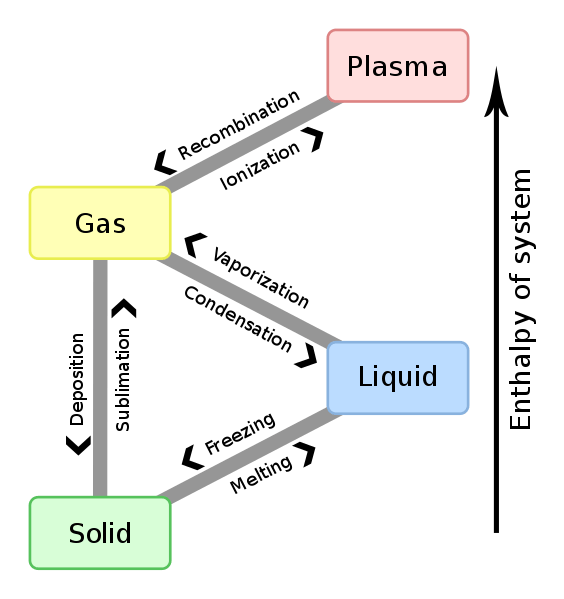
Figura 01: Relación entre el cambio de entalpía y el cambio de fase
El cambio en la entalpía entre cualquier par de reactivos y productos es independiente del camino entre ellos. Además, el cambio de entalpía depende de la fase de los reactivos. Por ejemplo, cuando los gases de oxígeno e hidrógeno reaccionan para producir vapor de agua, el cambio de entalpía es -483.7 kj. Sin embargo, cuando los mismos reactivos reaccionan para producir agua líquida, el cambio de entalpía es -571.5 KJ.
2h2 (g) +o2 (g) → 2h2O (g); ∆H = -483.7 kj
2h2 (g) +o2 (g) → 2h2O (l); ∆H = -571.7 kj
Que es la entropía?
Algunas cosas suceden espontáneamente, otras no. Por ejemplo, el calor fluirá de un cuerpo caliente a uno más frío, pero no podemos observar lo contrario a pesar de que no viola la regla de conservación de la energía. Cuando ocurre un cambio, la energía total permanece constante pero se repara de manera diferente. Podemos determinar la dirección del cambio mediante la distribución de la energía. Un cambio es espontáneo si conduce a una mayor aleatoriedad y caos en el universo en su conjunto. Podemos medir el grado de caos, aleatoriedad o dispersión de energía por una función de estado; Lo nombramos como la entropía.
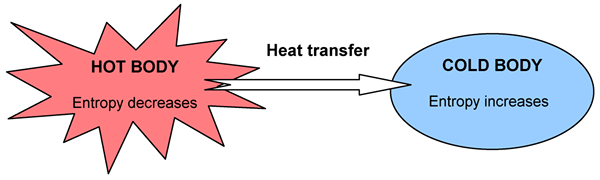
Figura 02: Un diagrama que muestra el cambio en la entropía con transferencia de calor
La segunda ley de la termodinámica está relacionada con la entropía, y dice: “La entropía del universo aumenta en un proceso espontáneo."La entropía y la cantidad de calor generado se relacionan entre sí en la medida en que el sistema usaba energía. De hecho, la cantidad de cambio de entropía o trastorno adicional causado por una cantidad dada de calor Q depende de la temperatura. Si ya hace mucho calor, un poco de calor extra no crea mucho más desorden, pero si la temperatura es muy baja, la misma cantidad de calor causará un aumento dramático en el desorden. Por lo tanto, podemos escribirlo de la siguiente manera: (Donde DS se cambia en entropía, DQ se cambia en calor y T es temperatura.
ds = dq/t
¿Cuál es la diferencia entre la entalpía y la entropía??
La entalpía y la entropía son dos términos relacionados en termodinámica. La diferencia clave entre la entalpía y la entropía es que la entalpía es que la transferencia de calor tiene lugar en una presión constante, mientras que la entropía da una idea de la aleatoriedad de un sistema. Además, la entalpía se relaciona con la primera ley de la termodinámica, mientras que la entropía se relaciona con la segunda ley de la termodinámica. Otra diferencia importante entre la entalpía y la entropía es que podemos usar la entalpía para medir el cambio en la energía del sistema después de la reacción, mientras que podemos usar la entropía para medir el grado de trastorno del sistema después de la reacción.
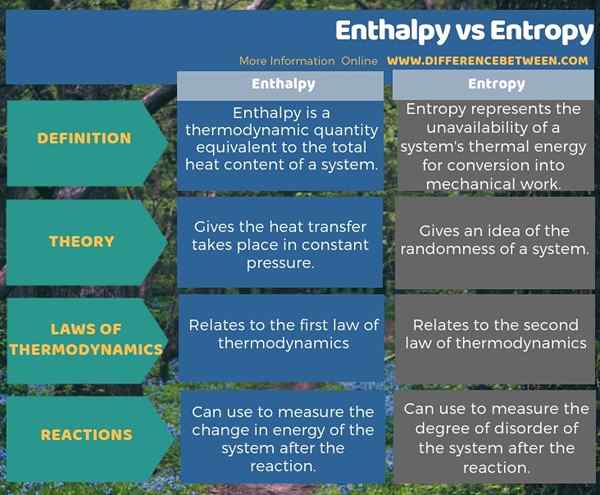
Resumen -Entalpía vs entropía
La entalpía y la entropía son términos termodinámicos que a menudo usamos con reacciones químicas. La diferencia clave entre la entalpía y la entropía es que la entalpía es que la transferencia de calor tiene lugar en una presión constante, mientras que la entropía da una idea de la aleatoriedad de un sistema.
Referencia:
1. Bibliotecas. "Entalpía."Bibliotecas de química, National Science Foundation, 26 de noviembre. 2018. Disponible aquí
2. Drake, Gordon W.F. "Entropía."Encyclopædia Britannica, Encyclopædia Britannica, Inc., 7 de junio de 2018. Disponible aquí
Imagen de cortesía:
1."Cambio de fase - en" por f l a n k e r, Penubag - trabajo propio, (dominio público) a través de Commons Wikimedia
2."Entropía caliente al frío" de Ibrahim Dincer y Yunus A. Cengel - Entropy 2001, 3 (3), 116-149; doi: 10.3390/E3030116 http: // www.MDPI.com/1099-4300/3/3/116, (CC por 3.0) a través de Commons Wikimedia


