Diferencia entre la entalpía y el calor
El diferencia clave Entre la entalpía y el calor es que La entalpía es la cantidad de calor transferido durante una reacción química a presión constante, mientras que el calor es una forma de energía.
Para fines de estudio en química, dividimos el universo en dos: un sistema y sus alrededores. El sistema es el tema de nuestra investigación, mientras que el resto es el entorno. El calor y la entalpía son dos términos que describen el flujo de energía y las propiedades de un sistema.
CONTENIDO
1. Descripción general y diferencia de claves
2. Que es la entalpía
3. Que es el calor
4. Comparación de lado a lado: entalpía vs calor en forma tabular
5. Resumen
Que es la entalpía?
En la termodinámica, la energía total de un sistema es la energía interna. La energía interna especifica la energía cinética y potencial total de las moléculas en el sistema. La energía interna de un sistema se puede cambiar haciendo trabajo en el sistema o calentándolo. Sin embargo, el cambio en la energía interna no es igual a la energía que se transfiere como calor cuando el sistema es capaz de cambiar su volumen.
La entalpía es una propiedad termodinámica y podemos denotarla por H. La relación matemática para este término es la siguiente:
H = U + PV
Aquí, H es entalpía y U es la energía interna, P es la presión y V es el volumen del sistema. Esta ecuación muestra que la energía suministrada como calor a una presión constante es igual al cambio de entalpía. El término PV explica la energía requerida por el sistema para cambiar el volumen contra la presión constante. Por lo tanto, la entalpía es básicamente el calor de una reacción a presión constante.

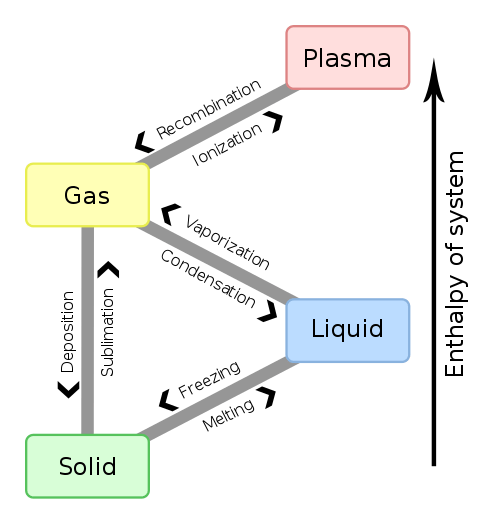
Figura 01: Cambios de entalpía para los cambios de fase de la materia
Además, el cambio de entalpía (∆H) para una reacción en una temperatura y presión dada se obtiene restando la entalpía de los reactivos de la entalpía de los productos. Si este valor es negativo, entonces la reacción es exotérmica. Si el valor es positivo, entonces se dice que la reacción es endotérmica. El cambio en la entalpía entre cualquier par de reactivos y productos es independiente del camino entre ellos. Además, el cambio de entalpía depende de la fase de los reactivos. Por ejemplo, cuando los gases de oxígeno e hidrógeno reaccionan para producir vapor de agua, el cambio de entalpía es -483.7 kj. Pero, cuando los mismos reactivos reaccionan para producir agua líquida, el cambio de entalpía es -571.5 KJ.
Que es el calor?
La capacidad de un sistema para trabajar es la energía de ese sistema. Podemos trabajar en el sistema o el sistema puede funcionar, lo que lleva a aumentar o disminuir la energía del sistema en consecuencia. La energía de un sistema se puede cambiar, no solo por el trabajo en sí, por otros medios también. Cuando la energía de un sistema cambia como resultado de la diferencia de temperatura entre el sistema y su entorno, nos referimos a esa energía transferida como calor (Q); es decir, la energía se ha transferido como calor.

La transferencia de calor tiene lugar de alta temperatura a baja temperatura, que está de acuerdo con un gradiente de temperatura. Además, este proceso continúa hasta que la temperatura entre el sistema y el circundante alcanza el mismo nivel. Hay dos tipos de procesos de transferencia de calor. Son procesos endotérmicos y procesos exotérmicos. El proceso endotérmico es un proceso en el que la energía ingresa al sistema desde los alrededores como calor, mientras que un proceso exotérmico es aquel en el que el calor se transfiere del sistema al entorno.
¿Cuál es la diferencia entre entalpía y calor??
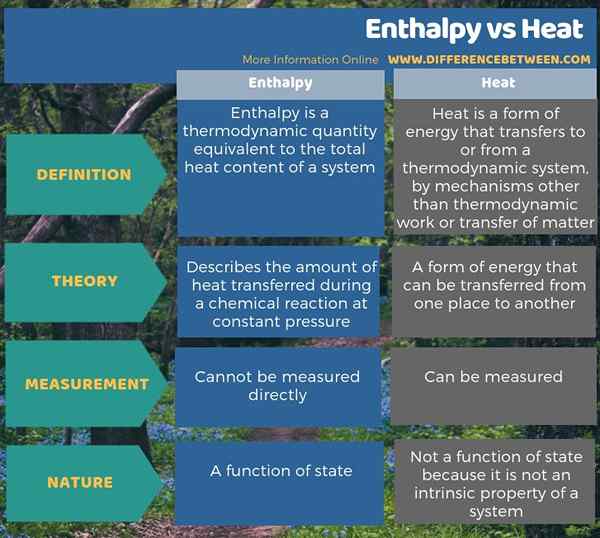
La mayoría de las veces, usamos los términos entalpía y calor indistintamente, pero hay una ligera diferencia entre entusiasmo y calor. La diferencia clave entre la entalpía y el calor es que la entalpía describe la cantidad de calor transferido durante una reacción química a presión constante, mientras que el calor es una forma de energía. Además, la entalpía es una función del estado, mientras que el calor no es ya que el calor no es una propiedad intrínseca de un sistema. Además, no podemos medir la entalpía directamente, por lo que tenemos que calcularla a través de ecuaciones; Sin embargo, podemos medir el calor directamente como un cambio de temperatura.
Resumen -Entalpía vs calor
A menudo usamos los términos entalpía y calor indistintamente, pero hay una ligera diferencia, la entalpía y el calor es que la entalpía describe la cantidad de calor transferido durante una reacción química a presión constante, mientras que el calor es una forma de energía.
Referencia:
1. Helmenstine, Anne Marie. “Definición de entalpía en química y física."Thinkco, agosto. 22, 2019, disponible aquí
Imagen de cortesía:
1. "Cambio de fase - EN."Por f l a n k e r, Penubag - trabajo propio (dominio público) a través de Commons Wikimedia
2. "Imagen sin calor sin calor de fuego" (CC0) a través de Needpix.comunicarse