Diferencia entre la entalpía de la atomización y la disociación de enlaces
El diferencia clave entre la entalpía de la atomización y la disociación de enlaces es que La entalpía de la atomización describe la energía requerida para separar una molécula en sus átomos, mientras que la entalpía de la disociación de enlaces describe la disociación de enlaces químicos en una molécula.
A veces, la entalpía de la atomización y la entalpía de la disociación de enlaces son las mismas para algunos compuestos simples si hay enlaces simples. Esto se debe a que, en compuestos simples, la disociación de enlaces forma los átomos de los cuales está hecha la molécula de.
CONTENIDO
1. Descripción general y diferencia de claves
2. ¿Qué es la entalpía de la atomización?
3. ¿Qué es la entalpía de la disociación de enlaces?
4. Comparación de lado a lado: entalpía de atomización frente a la disociación de enlaces en forma tabular
5. Resumen
¿Qué es la entalpía de la atomización??
La entalpía de la atomización es el cambio en la entalpía que ocurre al separar una sustancia química completamente en sus átomos. Esta sustancia química puede ser un elemento químico o un compuesto químico. Podemos denotar este cambio de entalpía como ΔHen. Durante el proceso de atomización, todos los tipos de enlaces químicos se descomponen y no se forman ninguno. Por lo tanto, la entalpía de la atomización es siempre un valor positivo. El valor de entalpía estándar para este cambio de entalpía es la "entalpía estándar de la atomización". Las condiciones estándar consideradas en este contexto son las 268.Temperatura de 15 k y presión de 1 barra.
Por ejemplo, la entalpía de la atomización para la molécula de agua se refiere a la energía requerida para separar los dos átomos de hidrógeno y el átomo de oxígeno en la molécula de agua. En otras palabras, la entalpía de la atomización para el agua es la suma de las energías de disociación de enlaces de dos enlaces O-H. Del mismo modo, la entalpía de la atomización para un sólido elemental es la entalpía de la sublimación para esa sustancia porque la sublimación implica la conversión del sólido en un gas monoatómico tras la evaporación.
¿Qué es la entalpía de la disociación de enlaces??
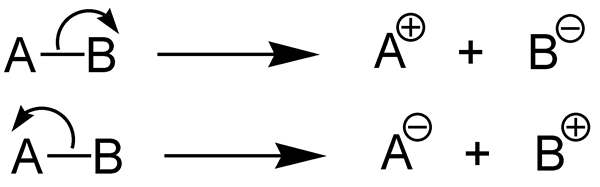
La entalpía de la disociación del enlace describe el cambio de entalpía que ocurre durante la disociación de un enlace químico. En otras palabras, es la medida de la fuerza de un enlace químico. Por lo tanto, podemos decir que el cambio de entalpía estándar que ocurre cuando el enlace químico A-B se descompone mediante la hemólisis y los fragmentos A y B es la entalpía de la disociación de enlaces. Si la molécula que estamos considerando es una molécula diatómica, entonces la entalpía de disociación de enlaces es igual a la entalpía de la atomización. Por lo general, los fragmentos A y B dados por esta disociación de enlaces son especies radicales. Podemos denotar la entalpía de la disociación de bonos como DH0.

Existen diferentes métodos que podemos usar para medir la disociación del enlace, como la determinación espectrométrica de los niveles de energía, la generación de radicales por pirólisis o fotólisis, mediciones de cinética y equilibrio químicos, varios métodos calorimétricos y electroquímicos, etc.
¿Cuál es la diferencia entre la entalpía de la atomización y la disociación de enlaces??
La diferencia clave entre la entalpía de la atomización y la disociación de enlaces es que la entalpía de la atomización describe la energía requerida para separar una molécula en sus átomos, mientras que la entalpía de la disociación de enlaces describe la disociación de enlaces químicos en una molécula. La entalpía de disociación de enlaces y la entalpía de la atomización son siempre valores positivos. A veces, la entalpía de la atomización y la entalpía de la disociación de enlaces son las mismas para algunos compuestos simples si hay enlaces simples. Sin embargo, estos términos difieren entre sí la mayoría de las veces.
Por debajo de las tablas infográficas más diferencias entre la entalpía de la atomización y la disociación de enlaces.
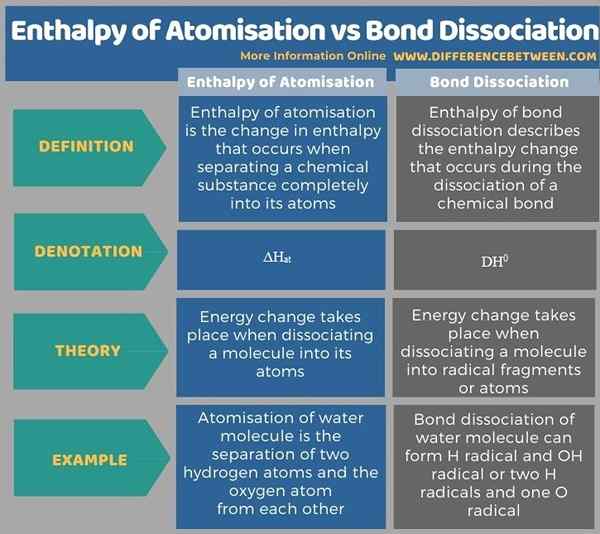
Resumen -Entalpía de la atomización vs disociación de enlaces
La entalpía de la atomización y la disociación de enlaces se puede usar indistintamente para algunos compuestos simples, pero no siempre son equivalentes. La diferencia clave entre la entalpía de la atomización y la disociación de enlaces es que la entalpía de la atomización describe la energía requerida para separar una molécula en sus átomos, mientras que la entalpía de la disociación de enlaces describe la disociación de enlaces químicos en una molécula.
Referencia:
1. "La entalpía de la atomización."Wikipedia, disponible aquí.
Imagen de cortesía:
1. "Heterólisis (Química)" de Jürgen Martens - Jürgen Martens (CC By -SA 3.0) a través de Commons Wikimedia


