Diferencia entre la igualación y la neutralización
El diferencia clave entre la igualación y la neutralización es que La igualación se refiere al equilibrio de los átomos de una ecuación de reacción química, mientras que la neutralización es el equilibrio de la acidez o la basicidad para obtener una solución neutral.
Aunque los términos ecualización y neutralización suenan similares, son diferentes entre sí en significado y aplicación. Sin embargo, ambos términos se refieren al proceso de equilibrio de los componentes químicos.
CONTENIDO
1. Descripción general y diferencia de claves
2. Que es la igualación
3. Que es la neutralización
4. Comparación de lado a lado: ecualización versus neutralización en forma tabular
5. Resumen
Que es la igualación?
La ecualización es la técnica de equilibrar los átomos de una ecuación de reacción química. Aquí, tenemos que igualar el número de átomos en el lado reactivo al número de átomos en el lado del producto. Esto significa atomicidad antes y después de la reacción química debe ser igual. Para este propósito, podemos usar coeficientes estequiométricos frente a reactivos y productos (un coeficiente estequiométrico es un número que aparece ante el símbolo de las especies químicas en la ecuación para una reacción química. Estos valores son valores sin unidad).
Los siguientes pasos nos ayudan a equilibrar una ecuación química para una reacción química simple.
- Escriba la ecuación desequilibrada. (MI.gramo. C3H8 + O2 ⟶ CO2 + H2O)
- Determine los números de cada átomo presentes tanto en el lado reactivo como en el lado del producto. (En el lado reactivo hay 8 átomos de hidrógeno, 3 átomos de carbono y 2 átomos de oxígeno. En el lado del producto, hay 2 átomos de hidrógeno, 3 átomos de oxígeno y un átomo de carbono).
- Ahorre los átomos de hidrógeno y oxígeno para el último.
- Use coeficientes estequiométricos para equilibrar elementos individuales. (Use el coeficiente estequiométrico "3" frente a CO2) E.gramo. C3H8 + O2 ⟶ 3CO2 + H2O
- Equilibrar el número de átomos de hidrógeno. (Hay 8 átomos de hidrógeno en el lado del reactivo pero solo 2 en el lado del producto, por lo tanto, debemos usar el coeficiente estequiométrico 4 frente a H2O) e.gramo. C3H8 + O2 ⟶ 3CO2 + 4H2O
- Equilibrar el número de átomos de oxígeno. mi.gramo. C3H8 + 5O2 ⟶ 3CO2 + 4h2O
Que es la neutralización?
Una reacción de neutralización es una reacción química entre un ácido y una base, que produce una solución neutral. Una solución neutral siempre tendrá ph 7. Esta reacción implica la combinación de iones H+y iones para formar moléculas de agua.
Si el pH final de una mezcla de reacción ácida y base es 7, eso significa que se han reaccionado cantidades iguales de H+y Oh-. Los ácidos y bases reaccionados pueden ser fuertes o débiles. Las reacciones varían según este hecho.

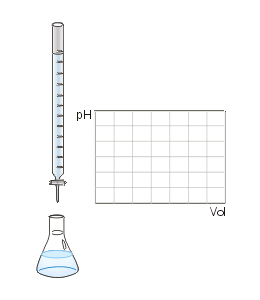
Figura 01: una fuerte titulación de neutralización de la base de ácido de ácido
Hay cuatro tipos diferentes de reacciones de neutralización: fuertes reacciones de base de ácido-strong, fuertes reacciones de base de agua ácida, reacciones de base débiles de envasado ácido y reacciones de base de peso ácido débiles. Estas reacciones sufren neutralización en diferentes grados, dependiendo de la resistencia del ácido y la base.
¿Cuál es la diferencia entre ecualización y neutralización??
La diferencia clave entre la ecualización y la neutralización es que la ecualización se refiere al equilibrio de los átomos de una ecuación de reacción química, mientras que la neutralización es el equilibrio de la acidez o la basicidad para obtener una solución neutral. Además, la ecualización implica el uso del número de átomos en reactivos y productos y el uso de los estados de oxidación de los átomos, mientras que la neutralización implica determinar la resistencia de los ácidos y las bases involucradas en la reacción.
Debajo de la infografía resume la diferencia entre ecualización y neutralización.
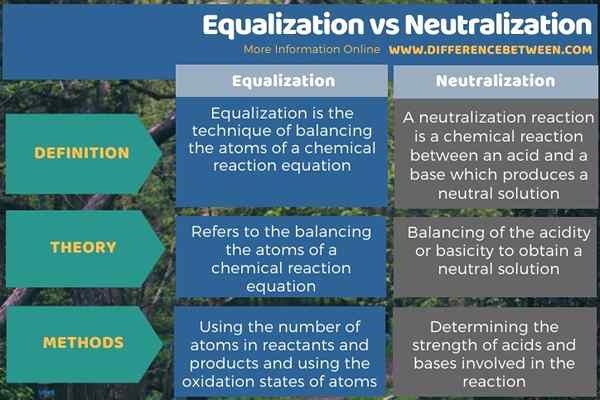
Resumen: igualación versus neutralización
Aunque el término ecualización y neutralización suenan similares, son diferentes entre sí en definición y aplicación. La diferencia clave entre la ecualización y la neutralización es que la ecualización se refiere a equilibrar los átomos de una ecuación de reacción química, mientras que la neutralización está equilibrando la acidez o la basicidad para obtener una solución neutral.
Imagen de cortesía:
2. "Titolazion" de Luigi Chiesa - Draw by Luigi Chiesa (dominio público) a través de Commons Wikimedia


