Diferencia entre equilibrio y estado estacionario
El diferencia clave entre el equilibrio y el estado estacionario es que En equilibrio, las concentraciones de todos los componentes se mantienen constantes, mientras que, en estado estacionario, solo algunos componentes se mantienen constantes.
Cuando uno o más reactivos se convierten en productos, pueden pasar por diferentes modificaciones y cambios de energía. Los enlaces químicos en los reactivos están rotos y se forman nuevos enlaces para generar productos que son totalmente diferentes de los reactivos. Esto es lo que llamamos una reacción química. El equilibrio y el estado estacionario son conceptos químicos importantes con respecto a diferentes reacciones químicas.
CONTENIDO
1. Descripción general y diferencia de claves
2. Que es el equilibrio
3. ¿Qué es estado estable?
4. Comparación de lado a lado: equilibrio frente a estado estacionario en forma tabular
5. Resumen
Que es el equilibrio?
Algunas reacciones son reversibles, mientras que algunas reacciones son irreversibles. En una reacción, los reactivos se convierten en productos. En algunas reacciones, los reactivos se generan nuevamente a partir de los productos. Nombramos este tipo de reacciones como reversible. En reacciones irreversibles, una vez que los reactivos se convierten en productos, no se regeneran nuevamente de los productos.
En una reacción reversible, cuando los reactivos se transforman en productos, lo llamamos reacción directa. Cuando los productos se transforman en reactivos, lo llamamos una reacción hacia atrás. Cuando la velocidad de reacciones hacia adelante y hacia atrás es igual, entonces la reacción está en equilibrio. Por lo tanto, la cantidad de reactivos y productos no cambia durante un período de tiempo.

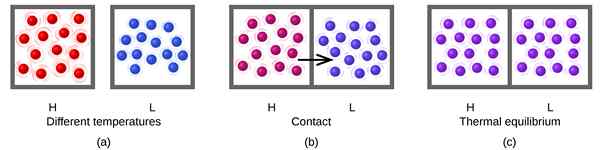
Figura 01: equilibrio térmico
Las reacciones reversibles siempre tienden a llegar al equilibrio y mantienen ese equilibrio. Cuando el sistema está en equilibrio, la cantidad de productos y los reactivos no tienen que ser necesariamente iguales. Puede haber una mayor cantidad de reactivos que los productos o viceversa. El único requisito en una ecuación de equilibrio es mantener una cantidad constante de ambos con el tiempo. Para una reacción en equilibrio, podemos definir una constante de equilibrio, que es igual a la relación entre la concentración de productos y la concentración de reacciones.
¿Qué es estado estable??
Considere una reacción en la que el Reactivo A va al Producto C a través de un intermedio B. En una reacción como esta, B está formado por A, y luego sufre el agotamiento para formar C. Antes de que comience la reacción, solo hay A, y B comienza a acumularse lentamente. Sin embargo, con el tiempo, la cantidad de A se reduce y C aumenta, pero la cantidad de B sigue siendo aproximadamente la misma con el tiempo. En este estado, tan pronto como se forme más B, agotará dar a C a una velocidad rápida manteniendo una concentración de estado estable. Por lo tanto, la tasa de síntesis de B = tasa de consumo de B.
A ⟶ b ⟶ c
Asunción de estado estacionario: d (b)/dt = 0.
¿Cuál es la diferencia entre equilibrio y estado estacionario??
El equilibrio y el estado estacionario son conceptos químicos importantes. La diferencia clave entre el equilibrio y el estado estacionario es que en el equilibrio, las concentraciones de todos los componentes se mantienen constantes, mientras que, en estado estacionario, solo algunos componentes se mantienen constantes. En el equilibrio, las concentraciones de componentes son constantes porque las velocidades de reacción son iguales en la reacción hacia adelante y hacia atrás. En estado estacionario, solo algunos componentes son constantes porque su tasa de síntesis y tasa de consumo son iguales. Para esto, las reacciones no necesariamente están en equilibrio.
Resumen -Equilibrio vs estado estacionario
El equilibrio y el estado estacionario son conceptos químicos importantes. La diferencia clave entre el equilibrio y el estado estacionario es que en el equilibrio, las concentraciones de todos los componentes se mantienen constantes, mientras que, en estado estacionario, solo algunos componentes se mantienen constantes.
Referencia:
1.Helmenstine, Anne Marie. "Equilibrio químico en reacciones químicas."Thinkco, febrero. 3, 2019, disponible aquí.
Imagen de cortesía:
1. "CNX Chem 05 01 HeatTrans1" por OpenStax - (CC por 4.0) a través de Commons Wikimedia


